| この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。出典を追加して記事の信頼性向上にご協力ください。(このテンプレートの使い方)
出典検索?: "有機電子論" – ニュース · 書籍 · スカラー · CiNii · J-STAGE · NDL · dlib.jp · ジャパンサーチ · TWL(2011年7月) |
有機化学において、有機電子論(ゆうきでんしろん、英: electronic theory of organic chemistry)とは、化学結合の性質および反応機構を、
の二者により説明する理論である。有機化学の領域では単に電子論(英: electronic theory)と呼ばれる。
1932年4月のR・ロビンソンの講演が、有機電子論が世に認められる契機となった[1]。1910年代にG・ルイスの研究により先鞭がつけられ、1920年代から1930年代にイギリス学派のロビンソンやC・K・インゴルドたちの研究により有機電子論が確立した。
日本における有機電子論は、上記の有機化学に関する"electronic theory"が第二次世界大戦時に「有機電子論」の名で輸入されたことに始まる[1]。その後、大阪大学(大阪帝国大学)の村上増雄が中心となって有機化合物の反応機構の研究が進展した[1]。
有機電子論は経験的パラメーターを使用した定性的な理論である。したがって、量子力学により電子の挙動を記述する今日の量子化学的反応論のような精密性は持ち合わせない。一方、対象となる反応物分子の官能基と他の基の配置が決まれば、化学反応が生じる位置や方向を推定するのには十分であることから、化学者が化学反応や合成計画を直感的に扱うには便利な理論である。
しかしながら定量性が無いために、例えばペリ環状反応や芳香族性などのように、本来の有機電子論では扱うことが出来ない反応や化学的性質が存在することも事実である。しかしそのような事例に対しては、例えば「超共役」の概念など、量子化学の知見をパラメーター化して、有機電子論を拡張することで対応することも可能であり、そのように量子化学概念で拡張された有機電子論は今日的な意義を失ってはいない。
ルイス以前には、化学結合の概念を表す原子価と原子構成要素の電子との間には明確な関連性は見出されていなかった。すなわちドルトンの倍数比例の法則から原子には結合部分を概念的に現す原子価というものが存在し、化学反応においては原子と原子の原子価を充当するように新しい結合が生成することが知られていた。い換えると原子価とは原子が他の原子と連結するための接合部位の数であり、原子と原子との原子価が充当された結果として化学結合が生成している。それゆえ、原子価が表現している実体は、化学結合の物理学的実体と等価と考えられた。その実体に関する研究は無機化合物において先行し、原子価の変化は酸化数変化と対応づいており、電子の移動が原子価が表現している実体であることが明確になった。同時に電子の移動により発生する電荷の偏りから生じる静電的相互作用の力(クーロン力)がイオン結合の実体であることも判明したので、電子が原子価と化学結合(正確にはイオン結合)の主体であると説明付けられた。
一方、無機化学とイオン性固体の対極に有機化学と共有結合性固体が存在しており、当時から両者の間は性質が連続的に変化することは知られていたので、有機化学の共有結合では電子がどのように関与しているかの理論構築が求められるようになった。これについて先鞭をつけたのがルイスの「価電子理論」である。
ルイスは第2周期元素について、他の原子に電子を与えうる最大数に相当する「原子価」と(彼の定義するところの)他の原子から電子を受領する最大余地に相当する「逆原子価」との差がどの元素も8であることに着目し、元素の原子構造には化学反応に関与する「殻」(すなわち価電子)と「Kernel」(今日で言うところの原子核と内殻電子)とから構成されると論じた。
ルイスの価電子理論では価電子の性質として次のように述べている。
- 各原子は電子殻を有し、(多くの場合)電子殻に存在する価電子の最大数は8である。
- 結合している原子同士は電子対を移動させることで価電子を共有する。すなわち、この場合の電子は対をなして移動する。
ルイスは価電子理論をボーアの電子モデルとは独立して提唱している(ルイス自身は価電子理論の論文でボーア・モデルに対して否定的な見解を示している)。
 価電子とルイスの電子式
価電子とルイスの電子式
あわせてルイスは化合物における価電子の共有状態を現すために、ルイスの電子式(ルイス化学式)を提案している。すなわち化合物の原子を結合している物同士が隣接するように配置し、共有している価電子を該当する元素記号の間隙の二つの点で表現する図式である。ルイス化学式は価電子論の表現形なので1つの元素記号の周囲の点の数の最大値は8になる。また、ルイスが指摘しているように二つの原子の間の電子の共有は電子対を単位とするので、ルイス化学式においても共有されている電子は必ず対を形成している。
ルイスは電子殻の概念を提唱はしているが、「なぜ電子殻を構成する価電子の最大数が8であるか」、「なぜ電子は対で動くのか」とか、「電子殻を共有するということがなぜ生ずるのか」という原因については説明しきれておらず、価電子の理論を仮説として有機電子論を構築している。
実際、これらの仮説の疑問に対する解答には量子化学的な化学結合の解釈が必要となる。例えば、電子殻の最大数は原子軌道の数で規定されており、そのために価電子の最大数が決定されている。また電子が対で動くのは、各原子軌道にはパウリの排他律により最大2電子しか占有できず、フント則で示されているように軌道上に単独の電子が存在するよりも軌道上の電子対の方がエネルギー的に安定な為である。
また、共有結合で電子殻を共有することの意味は、原子軌道が混成してσ結合軌道を形成し、元の原子軌道から電子が遷移することである。右上の図で水の場合の共有結合をルイスの価電子理論と量子化学的な電子軌道のエネルギー準位で示している。ルイスの価電子理論では水素と酸素とが共有結合することで、酸素の価電子が8になり安定化であると説明される。
一方、量子化学的には水素のs軌道2原子分(2個)と酸素のs軌道1個、p軌道1個の計4個の原子軌道が混成により分子軌道を形成すると考えられる。すなわちσとσ*とが2個ずつ、計4個の分子軌道が生成する。そこに水素と酸素との原子軌道からパウリの排他律を満たしつつエネルギー準位が最も低くなる組み合わせで4つの電子が入って共有結合が形成されている。い換えると、量子化学では生成する電子軌道の準位を定量的に扱うことが可能であり、実際共有結合が生成するのは、原子軌道と分子軌道とを比べるとエネルギー準位的に分子軌道の方が低いのでエネルギー的に結合生成が優位になるためである。
しかし、単に反応前後の分子の構造に着目するだけであれば、量子化学的な分子軌道のエネルギー準位よりはルイスの構造式の方が、反応形式のシンボルとして直感的に判りやすくモデルとして使いやすいともいえる。
またルイスは物性に着目して「極性分子」と「無極性分子」という区分を設けて化学結合について考察している。すなわち分子を構成している結合は、典型的な極性分子とその対極の典型的な無極性分子との間に位置づけられると考えている。ここでいう極性分子とは現在でいうところのイオン結合であり、無極性分子とは同種元素間の共有結合性の単結合である。
い換えると、分子を構成する化学結合はイオン結合から共有結合へと性質が連続的に変化する中間の性質をもっており、ある結合を取り上げてこれはイオン結合あるいは共有結合と弁別的にとらえることは困難である。もちろん、典型的なイオン結合や典型的な共有結合というのも存在はするが、分子を構成する化学結合の多くは大なり小なり両者の性質を併せ持っている。すなわち共有結合に分極が生じており、分極の程度は結合を介して相対する元素の性質(永久分極)や周囲の静電的な環境変化(静電相互作用による動的な分極)によって決定されるとした。そして、分極の度合いが進行した極限では共有結合の性質は失われ、正と負とのイオン対からなるイオン結合となると考えられる。
ルイスは分子の双極子モーメント測定結果から、ある原子の静電効果が結合を介して隣接する他の原子の静電効果に影響を及ぼすことを指摘している。例えば塩素原子が結合したα位、β位の炭素は、連結数を経るにつれて作用は減弱するものの、塩素原子に電子が引き付けられ、塩素原子が存在しない場合よりも価電子の作用が減弱した性質を示す。この様に電子親和性(い換えるならば電気陰性度)が化学結合を介して他の原子の静電的環境に影響を及ぼす作用をロバート・ロビンソンは誘起効果(I効果、Inductive effect)と呼称した。
誘起効果が物理現象として明確に現れる例として、置換基と酸または塩基性の強度との相関が挙げられる。例えば、カルボン酸誘導体に対して電子求引性基である塩素基が置換したケースについて説明する。酢酸に対して、モノクロロ酢酸、ジクロロ酢酸そしてトリクロロ酢酸のpKaを次に示す。
- CH3COOH - pKa = 4.74
- ClCH2COOH - pKa = 2.87
- Cl2CHCOOH - pKa = 1.25
- Cl3CCOOH - pKa = 0.77
このように、塩素の置換数が増大するにつれて強酸性となる。い換えるとカルボン酸のOH基の酸素上の電子密度が低いほど解離が進行しやすく、この例では塩素のI効果(I−効果)により、酸素上の電子が塩素側に引き付けられ、置換した塩素基の数が多いほどI−効果が強く現れ、pKaが減少傾向を示したと説明することができる。
逆の例として酢酸にメチル基を置換した例が挙げられる。メチル基は電子供与性を示し、それがI効果(I+効果)により、カルボン酸の電子密度を増やしpKaが増大したと説明することができる。
- CH3CH2COOH - pKa = 4.88
- (CH3)2CHCOOH - pKa = 4.86
- (CH3)3CCOOH - pKa = 5.05
- CH3(CH2)2COOH - pKa = 4.82
- CH3(CH2)3COOH - pKa = 4.86
このように、電子求引性の誘起効果をI−効果、電子供与性の誘起効果をI+効果と呼称することがある。また、配位結合を正負のイオン対が接合した状態とみなすことができ、配位結合を→で示すことの比喩で、I効果が存在する共有結合を
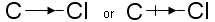 の記号で表示する場合がある。
の記号で表示する場合がある。
 メソメリー効果
メソメリー効果
有機反応論においてカルボニル化合物などに存在すると想定された分極を生じる機構を、クリストファー・ケルク・インゴルドはメソメリー効果(M効果、mesomeric effect)と呼んだ。すなわち、カルボニルの二重結合が立ち上がり、カルボニル炭素が正にカルボニル酸素が負に分極する機構の呼称である。なお、共役カルボニル系化合物などでメソメリー効果というべきところを、有機反応論の後に発展した量子化学分野の原子価結合法の概念である「共鳴効果」と呼称することがあるが、有機反応論には「共鳴」の概念は無く正しい用語の使用方法ではない。一方インゴルドのメソメリー効果に先立って、ロビンソンは互変異性の機構に類似した電子対の移動で分極が転移する機構を示唆しており、その機構をエレクトロメトリーあるいは及ぼす効果に対してエレクトロメトリー効果(E効果)という呼称を与えている。
誘起効果はβ位、すなわち共有結合した原子で2つ以上を介した場合はほとんどその影響がなくなるのに対して、共役した二重結合系のメソメリー効果はより広い間隔があっても効果の作用を現す。メソメリー効果の例としてアニリンとp-トルイジンの塩基性の違いが挙げられる。p-位に置換したメチル基からの電子供与性を示し、それがM効果により、窒素原子上の電子密度を増やし塩基性が増大したと説明することができる。
電子求引性基と電子供与性基[ソースを編集]
分子の特定の位置について、電子密度を減弱させる効果を持つ置換基の性質を電子求引性と呼び、逆に増加させる効果を持つ場合の性質を電子供与性と呼ぶ。このような効果を持つ置換基を電子求引性基あるいは電子供与性基と呼び表す。電子求引性あるいは電子供与性は単に電気陰性度の差だけでは説明できない。すなわち前述の誘起効果、メソメリー効果等が複合的に作用するので、芳香族性や共役系の存在やトポロジー的な位置関係によって現れ方が変わってくる。
誘起効果の場合、電子求引性のものを−I効果、電子供与性の場合を+I効果と表すが、炭素よりも電気陰性度の高い原子は−I効果を示す。またアニオンは+I効果を、カチオンは−I効果を示す。
メソメリー効果の場合は電子求引性のものを−M効果、電子供与性の場合を+M効果と表す。
| |
電子供与性 |
電子求引性
|
| 誘起効果
|
+I効果
- -N−R > -O−
- -O− > -S−
- (CH3)3C- > (CH3)2CH- > CH3CH2- > CH3-
|
−I効果
- -O+R2 > -N+R3
- -N+R3 > -P+R3 > …
- -O+R2 > -S+R2 > …
- -N+R3 > -NO2 > -SO2R > -SOR
- -SO2R > -SO3R
- -N+R3 > -NR2
- -O+R2 > -OR
- -S+R2 > -SR
- -F > -Cl > -Br > -I
- =O > =NR > =CR2
- =O > -OR
- ≡N > ≡CR
- =O > -OR
- ≡N > =NR > -NR2
- -C≡CR > -CR=CR2 > -CR2CR3
|
| メソメリー効果
|
+M効果
- -C−R2 > -N−R > -O−
- -NR− > -NR2
- -O− > -OR > -O+R2
- -S− > -SR > -S+R2
- -I > -I+R
- -NR2 > -OR > -F
- -SR > -OR
- -I > -Br > -Cl > -F
|
−M効果
- =N+R3 > =NR
- =O > =NR > =CR2
- =S > =O > ≡N
|
表のこれらの強度は傾向あるいは相対強度を示している。相反する効果が相乗した場合などでは量子化学的計算などで絶対値を推定する必要がある。
例えば、メトキシ基(-OCH3)が置換したベンゼンの場合、隣接するオルト位炭素に対しては酸素の電気陰性度によるI効果で僅かに電子密度を減弱させ、メタ位、パラ位にはさほど影響を与えない。それよりも酸素の非共有電子対の押し込みによるM効果でオルト-パラ位炭素への電子密度を増大させる効果の方が支配的である為、メトキシ基は芳香環上の求電子置換反応では電子供与性基として作用する。
これらの効果を、パラおよびメタ置換安息香酸の酸解離定数をもとに、定量的に評価、予測する経験則として、ハメット則が知られる。
- ^ a b c 井本(2019), 44-45頁

の

