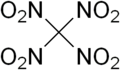四硝基甲烷
| 四硝基甲烷[1] | |||
|---|---|---|---|
| |||
| IUPAC Tetranitromethane | |||
| 别名 | TNM Tetan | ||
| 识别 | |||
| CAS |
509-14-8 | ||
| ChemSpider | 13842838 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | NYTOUQBROMCLBJ-UHFFFAOYAA | ||
| UN编号 | 1510 | ||
| RTECS | PB4025000 | ||
| KEGG | C19300 | ||
| CN4O8 | |||
| 196.04 g·mol⁻¹ | |||
| 1.623 g/cm3 | |||
| 熔点 | 13.8 °C(287 K) | ||
| 126 °C(399 K) | |||
| 危险 | |||
| 警示术语 | R:R8 R23/24/25 R36/38 R45 | ||
| S:S17 S45 | |||
| MSDS | ICSC 1468 | ||
| NFPA 704 | |||
| 硝基 三硝基甲烷 | |||
四硝基甲烷(
用途 [编辑]
四硝基甲烷曾被研究用作
合成 [编辑]
四硝基甲烷在1857
实验
四硝基甲烷的首次大规模工业生产则要追溯到
安全 性 [编辑]
纯四硝基甲烷完全无法发生爆炸——
四硝基甲烷具有高毒性。
参考 资料[编辑]
- ^ Merck Index, 11th Edition, 9164.
- ^ J. G. Tschinkel. Tetranitromethane as Oxidizer in Rocket Propellants. Industrial and Engineering Chemistry. 1956, 48 (4): 732. doi:10.1021/ie50556a022.
- ^ K. V. Altukhov, V. V. Perekalin. The Chemistry of Tetranitromethane. Russian Chemical Reviews. 1976, 45 (11): 1052–1066. doi:10.1070/RC1976v045n11ABEH002759.
- ^ L. N. Shishkov. Sur la constitution de l'acetic fulminique et un nouvelle serie de corps derives de l'acide acetique. Annales de chimie et de physique. 1857, 49 (11): 310 [2012-08-13]. (
原始 内容 存 档于2012-02-17). - ^ Org. Syn. Coll. Vol. III, 1955, 803.
- ^ Mahoney vs Nitroform Co., 114 A.2d 863 (NJ Appellate Div 1955).
- ^ F. D. Chattaway. A simple method of preparing tetranitromethane. Journal of the Chemical Society. 1910, 97: 2099–2102. doi:10.1039/CT9109702099.
- ^ K. F. Hager. Tetranitromethane. Industrial and Engineering Chemistry. 1949, 41 (10): 2168–2172. doi:10.1021/ie50478a028.
- ^ K. J. P. Orton, P. V. McKie. The action of nitric acid on unsaturated hydrocarbons. The action of nitric acid on acetylene. Journal of the Chemical Society. 1920, 117: 283–297. doi:10.1039/CT9201700283.
- ^ Urbanski, Tadeusz. Chemistry and Technology of Explosives I. Pergamon Press. 1964: 589–594.
- ^ Urbanski, Tadeusz. Chemistry and Technology of Explosives I. Pergamon Press. 1964: 593. LCCN 83002261.
- ^ National Toxicology Program. Report On Carcinogens – Twelfth Edition – 2011 – Tetranitromethane (PDF). National Toxicology Program. [2012-08-14]. (
原始 内容 (PDF)存 档于2013-01-31).
外部 链接[编辑]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||