ニトロゲナーゼ
ニトロゲナーゼ (nitrogenase, EC 1.18.6.1) はリゾビウム (Rhizobium)
反応 [編集 ]
窒素 固定 化 [編集 ]
ニトロゲナーゼの
- N2 + 8H+ + 8e- + 16 ATP → 2NH3 + H2 + 16ADP + 16Pi・・・
反応 式 2
- 2H+ + 2e- + 4ATP + 4H2O → H2 + 4ADP + 4Pi・・・
反応 式 3
この
副 反応 [編集 ]
- N2O + 2H+ + 2e- → N2 + H2O
- CN- + 7H+ + 6e- → CH4 + NH3
- CH3NC + 6H+ + 6e- → CH3NH2 + CH4
- N3- + 3H+ + 2e- → N2 + NH3
- C2H2 + 2H+ + 2e- → C2H4
- CH2CHCH + 2H+ + 2e- → CH2CH2CH2
- H2N-CN + 6H+ + 6e- → NH3 + CH3NH2
- CH2NN + 6H+ + 6e- → CH3NH2 + NH3
電子 供与 体 [編集 ]
ニトロゲナーゼ
分布 [編集 ]
ニトロゲナーゼは
絶対 嫌気 性 細菌 ・・・Clostridium, Desulfovibrio, Desulfotomaculum通性 嫌気 性 細菌 ・・・Klebisiella, Bacillus好 気性 細菌 ・・・Azotobacter, Azomonas, Beijerinckia光合成 細菌 ・・・Chromatium, Rhodospirillum, Rhodobacter- シアノバクテリア・・・Anabaena, Nostoc, Gloeocapsa
根粒 菌 (Rhizobium)
- エンドウ
根粒 菌 ・・・R. legminosarum(エンドウ、ソラマメ) - サイトウ
根粒 菌 ・・・R. phaseoli(インゲン) - ダイズ
根粒 菌 ・・・R. japonicum(ダイズ) - クローバー
根粒 菌 ・・・R. trifolii(クローバー) - ルーピン
根粒 菌 ・・・R. lupini(ルーピン) - アルファルファ
根粒 菌 ・・・R. meliloti(ウマゴヤシ、シナガワハギ) - カウピー
根粒 菌 ・・・“Cowpea rhizobia”(カウピー、ナンキンマメ、アズキ)
分類 [編集 ]
ニトロゲナーゼは
- モリブデン、バナジウムおよび
鉄 型 ニトロゲナーゼの全 てを有 する・・・Azotobacter vinelandii[13] - モリブデンおよび
鉄 型 ニトロゲナーゼを有 する・・・Rhodobacter capsulatus、Rhodospirillum rubrum [14][15] - モリブデンおよびバナジウム
含有 ニトロゲナーゼを有 する・・・Anabaena variablis[16] - モリブデン
含有 ニトロゲナーゼのみを有 する・・・Krebsiella pneumoniae[17]
立体 構造 [編集 ]
ニトロゲナーゼは
-
ニトロゲナーゼ
機能 単位 :ニトロゲナーゼ二 量 体 (黄 、青 )およびニトロゲナーゼ還元 酵素 二 量 体 構造 (白 、ピンク)。ポリペプチドを除去 した図表 が下部 『ニトロゲナーゼの補 因子 』。PDB: 1M34 -
ニトロゲナーゼ
二 量 体 :α サブユニット(緑 )およびβ サブユニット(赤 )の二 量 体 構造 。α サブユニット内 にはFeMo-coおよびホモクエン酸 が、両 サブユニット間 にはP-clusterが確認 できる。PDB: 1M34 -
ニトロゲナーゼ
還元 酵素 :ホモ二 量 体 構造 。白 およびピンクポリペプチド内 にはそれぞれMg-ATPが結合 している。また両 サブユニット間 に[4Fe-4S]クラスターが確認 できる。PDB: 1M34
ニトロゲナーゼ二 量 体 [編集 ]
ニトロゲナーゼ
-
FeMo-co
補 因子 :黄色 部 が硫黄 、灰色 部 が鉄 。ただし、左端 の灰色 はモリブデン。PDB: 1M34 -
P-cluster:
黄色 部 が硫黄 、灰色 部 が鉄 。PDB: 1M34
ニトロゲナーゼ還元 酵素 [編集 ]
ニトロゲナーゼ
反応 機構 [編集 ]
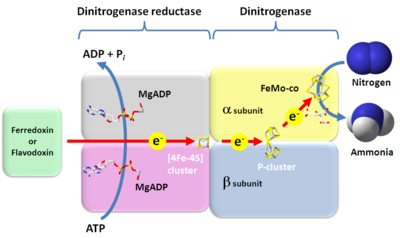
1960
電子 供与 体 (フェレドキシン、フラボドキシン)- ニトロゲナーゼ
還元 酵素 ([4Fe-4S]クラスター) - ATPおよび2
価 金属 イオン(マグネシウム、カルシウムなど) - ニトロゲナーゼ
二 量 体 (P-Cluster、FeMo-co) 電子 受容 体 (窒素 )
なお、
- ニトロゲナーゼ
還元 酵素 にATPおよびマグネシウムが結合 し、複 合体 をとる。この時 ニトロゲナーゼ還元 酵素 の標準 酸化 還元 電位 は-400 mV付近 まで低下 する。 電子 供与 体 からニトロゲナーゼ還元 酵素 -MgATP複 合体 に電子 伝達 がおこなわれ、本 複 合体 が還元 される。- ニトロゲナーゼ
還元 酵素 -MgATP複 合体 のATPが加水 分解 されより低 電位 の電子 となる。結合 しているATPはADPとなる。 - ニトロゲナーゼ
還元 酵素 -MgADP複 合体 の[4Fe-4S]クラスターを通 じて、ニトロゲナーゼ二 量 体 のP-clusterに電子 伝達 がおこなわれる。 - ニトロゲナーゼ
二 量 他 のP-clusterからFeMo-coに電子 伝達 がおこなわれる。 - FeMo-coが
窒素 を2電子 還元 するとN2H2を生 じる。 - FeMo-coがN2H2をさらに2
電子 還元 するとN2H4が生 じる。 - FeMo-coがN2H4をさらに2
電子 還元 すると2アンモニアが生 じる。 窒素 の還元 を行 っている際 、同時 にプロトンも還元 し、水素 が発生 する。
- ニトロゲナーゼ
還元 酵素 + 2Mg2+ + 2ATP → ニトロゲナーゼ還元 酵素 -MgATP複 合体 (酸化 型 ) - 2ニトロゲナーゼ
還元 酵素 -MgATP複 合体 (酸化 型 ) + 2e- → 2ニトロゲナーゼ還元 酵素 -MgATP複 合体 (還元 型 ) - 2ニトロゲナーゼ
還元 酵素 -MgATP複 合体 (還元 型 ) + 2ATP → 2ニトロゲナーゼ還元 酵素 -MgADP複 合体 (酸化 型 ) + 2ADP + 4Pi + 2e- - 1[4Fe-4S]クラスター(
酸化 型 ) + 2e- → 1[4Fe-4S]クラスター(還元 型 )+ 1P cluster(酸化 型 ) → 1[4Fe-4S]クラスター(酸化 型 ) + 1P cluster(還元 型 ) - 1P cluster(
還元 型 ) + 1FeMo-co(酸化 型 ) → 1P cluster(酸化 型 ) + 1FeMo-co(還元 型 ) - 1FeMo-co(
還元 型 ) + N2 → N2H2 - (1~5の2
回 目 サイクル)1FeMo-co(還元 型 ) + N2H2 → N2H4 - (1~5の3
回 目 サイクル)1FeMo-co(還元 型 ) + N2H4 → 2NH3 - 2H+ + 2e- + 4ATP + 4H2O → H2 + 4ADP + 4Pi
なお、FeMo-co
関連 遺伝子 および機能 [編集 ]
P clusterやFeMo-coといった
- nifH・・・ニトロゲナーゼ
還元 酵素 - nifD・・・ニトロゲナーゼ
二 量 体 α サブユニット - nifK・・・ニトロゲナーゼ
二 量 体 β サブユニット - nifT・・・
機能 不明 - nifY/nafY・・・ニトロゲナーゼ
二 量 体 のシャペロン。FeMo-coの挿入 にかかわる。 - nifE・・・FeMo-co
構築 - nifN・・・FeMo-co
構築 - nifX・・・FeMo-co
構築 - nifU・・・
鉄 硫黄 クラスター骨格 - nifS・・・
鉄 硫黄 クラスターの不安定 硫黄 の運搬 - nifV・・・ホモ
クエン酸 合成 酵素 - nifW・・・FeMo-co
安定 化 - nifZ・・・
機能 不明 - nifM・・・ニトロゲナーゼ
還元 酵素 の成熟 化 - nifF・・・フラボドキシン
- nifL・・・
陰性 調節 因子 - nifA・・・
陽性 調節 因子 - nifB・・・FeMo-co
構築 - fdnN・・・フェレドキシン
- nifQ・・・FeMo-co
構築 - nifJ・・・ピルビン
酸 :フラボドキシン(フェレドキシン)オキシドレダクターゼ
なお、バナジウム
発現 調節 [編集 ]
まず、ニトロゲナーゼ
酸素 耐 性 機構 [編集 ]
シアノバクテリアは
参考 文献 [編集 ]
- ^ a b
田宮 信雄 、八木 達彦 (1991)コーン・スタンプ生化学 第 5版 - ^ a b c d e R. H. Burris (1991) Nitrogenases, J. Biol. Chem., 266 (15), 9339-9342
- ^ J. M. Rivera-Ortiz and R. H. Burris (1975) J. Bacteriol., 123, 537-545
- ^ Rasmussen, L. J., Peters, G. K., and Burris, R. H. (1989) Phykos 28, 64-79
- ^ Yoneyama, T., Yamada, N., Kojima, H., and Yazaki, J. (1984) Plant Cell Physiol., 25, 1561-1565
- ^ L. E. Mortenson, (1964) Biochim. Biophys. Acta, 81, 473-478
- ^ Shah, V. K., Stacey, G., and Brill, W. J. (1983) J. Biol. Chem. 258, 12064-12068
- ^ B. Fodor, G. Rakhely, A. T. Kovacs and K. L. Kovacs (2001) Transposon mutagenesis in purple sulfur photosynthetic bacteria: identification of hypF, encoding a protein capable of processing [NiFe] hydrogenases in alpha, beta, and gamma subdivisions of the proteobacteria, Appl. Environ. Microbiol., 67, 2476-2483
- ^ Young, J. P. W. 1992. Phylogenetic classification of nitrogen-fixing organisms, p. 43-86. In G. Stacey, R. H. Burris, and H. J. Evans (ed.), Biological nitrogen fixation. Chapman and Hall, New York, N.Y.
- ^ a b
桜井 英博 、柴 岡 弘 郎 、清水 碩 (1997)植物 生理学 入門 、培風館 - ^ a b c Luis M. Rubio and Paul W. Ludden (2005) Maturation of Nitrogenase: a Biochemical Puzzle, J. Bacteriol., 187, 405-414
- ^ Bishop, P. E., D. M. L. Jarlenski, and D. R. Hetherington. 1980. Evidence for an alternative nitrogen fixation system in Azotobacter vinelandii. Proc. Natl. Acad. Sci. USA 77:7342-7346
- ^ Bishop, P. E., R. Premakumar, D. R. Dean, M. R. Jacobson, J. R. Chisnell, T. M. Rizzo, and J. Kopczynski. 1986. Nitrogen fixation by Azotobacter vinelandii strains having deletions in structural genes for nitrogenase. Science 232:92-94
- ^ Davis, R., L. Lehman, R. Petrovich, V. K. Shah, G. P. Roberts, and P. W. Ludden. 1996. Purification and characterization of the alternative nitrogenase from the photosynthetic bacterium Rhodospirillum rubrum. J. Bacteriol. 178, 1445-1450.
- ^ Schneider, K., A. Muller, U. Schramm, and W. Klipp. 1991. Demonstration of a molybdenum- and vanadium-independent nitrogenase in a nifHDKdeletion mutant of Rhodobacter capsulatus. Eur. J. Biochem. 195:653-661.
- ^ Thiel, T. 1993. Characterization of genes for an alternative nitrogenase in the cyanobacterium Anabaena variabilis. J. Bacteriol. 175:6276-6286
- ^ Arnold, W., A. Rump, W. Klipp, U. B. Priefer, and A. Puhler. 1988. Nucleotide sequence of a 24,206-base-pair DNA fragment carrying the entire nitrogen fixation gene cluster of Klebsiella pneumoniae. J. Mol. Biol. 203: 715-738.
- ^ Ribbe, M., D. Gadkari, and O. Meyer. 1997. N2 fixation by Streptomyces thermoautotrophicus involves a molybdenum-dinitrogenase and a manganese-superoxide oxidoreductase that couple N2 reduction to the oxidation of superoxide produced from O2 by a molybdenum-CO dehydrogenase. J. Biol. Chem. 272:26627-26633
- ^ a b Carnahan. J. E.. Mortenson. L. E.. Mower. H. F.. and Castle. J. E. (1960) Biochim. Biophys. Acta 38, 188-189
- ^ a b Carnahan. J. E.. Mortenson. L. E.. Mower. H. F.. and Castle. J. E. (1960) Biochim. Biophys. Acta 44, 520-535
- ^ Mortenson, L. E. (1965) in Non-Heme Iron Proteins: Role in Energy Conversion (San Pietro, A., ed) pp. 243-259, Antioch Press, Yellow Springs OH
- ^ Winter, H. C., and Burris, R. H. (1968) J. Biol. Chem. 243,940-944
- ^ Orme-Johnson, W. H., Hamilton, W. D., Ljones, T., Tso, M.-Y. W., Burris, R. H., Shah, V. K., and Brill, W. J. (1972) Proc. Natl. Acad. Sci. U. S. A. 69, 3142-3145
- ^ Zumft, W. G., and Mortenson, L. E. (1975) Biochim. Biophys. Acta 416, 1-52
- ^ John W Peters and Robert K Szilagyi (2006) Exploring new frontiers of nitrogenase structure and mechanism. Current Opinion in Chemical Biology, 10:101-108
- ^ Dos Santos, P. C., D. R. Dean, Y. Hu, and M. W. Ribbe. 2004. Formation and insertion of the nitrogenase iron-molybdenum cofactor. Chem. Rev. 104:1159-1173
- ^ Imperial, J., V. K. Shah, R. A. Ugalde, P. W. Ludden, and W. J. Brill. 1987. Iron-molybdenum cofactor synthesis in Azotobacter vinelandii Nif- mutants. J. Bacteriol. 169:1784-1786.
- ^ Roberts, G. P., MacNeil, T., MacNeil, D., andBrill, W. J. (1978) J. Bacteriol. 136, 267-279
- ^ Rangaraj, P., C. Ruttimann-Johnson, V. K. Shah, and P. W. Ludden. 2000. Biosynthesis of the iron-molybdenum and iron-vanadium cofactors of the nif- and vnf-encoded nitrogenases, p. 55-79. In E. W. Triplett (ed.), Prokaryotic nitrogen fixation: a model system for analysis of a biochemical process. Horizon Scientific Press, Wymondham, United Kingdom.
- ^ Kennedy, C., and D. Dean. 1992. The nifU, nifS and nifV gene products are required for activity of all three nitrogenases of Azotobacter vinelandii. Mol. Gen. Genet. 231:494-498.
- ^ Ludden, P. W., and Burns, R. H. (1976) Science 194,424-426
- ^ Ludden, P. W., and Roberts, G. P. (1989) Curr. Top. Cell. Regul. 30,23-56
- ^ Postgate, J. R. (1982) The Fundamentals of Nitrogen Fixation, Cambridge University Press, London
- ^ Bergmann, B., Gallon, J, R., Rai, A. N., and Stal, L. J., (1997) N2 fixation by non-heterocystous cyanobacteria. FEMS. Microbiol. Rev., 19, 139-185



![ニトロゲナーゼ還元酵素:ホモ二量体構造。白およびピンクポリペプチド内にはそれぞれMg-ATPが結合している。また両サブユニット間に[4Fe-4S]クラスターが確認できる。PDB: 1M34](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/Dinitrogenase_reductase.png/120px-Dinitrogenase_reductase.png)

