出典 しゅってん 百科 ひゃっか 事典 じてん
スルファミン酸 さん (スルファミンさん、英 えい sulfamic acid )は、硫酸 りゅうさん ヒドロキシ基 もと がアミノ基 もと に置換 ちかん 無色 むしょく 固体 こたい 別名 べつめい アミド硫酸 りゅうさん 。
水 みず 溶 と 比較的 ひかくてき 強 つよ 酸性 さんせい 示 しめ 固体 こたい 加熱 かねつ 分解 ぶんかい [1] 染料 せんりょう 染色 せんしょく 際 さい 残留 ざんりゅう 余剰 よじょう 亜 あ 硝酸塩 しょうさんえん 分解 ぶんかい 使用 しよう
構造 こうぞう 反応 はんのう 性 せい [ 編集 へんしゅう ] スルファミン酸 さん 構造 こうぞう 硫酸 りゅうさん 2 (OH) のヒドロキシ基 もと 基 もと 置換 ちかん 中性 ちゅうせい 型 がた 2 NSO2 (OH) ではなく、互変異性 いせい 体 たい である双 そう 性 せい 型 かた 3 N+ SO3 − で表 あらわ 結晶 けっしょう 中 ちゅう 個 こ 水素 すいそ 窒素 ちっそ 距離 きょり 中性子 ちゅうせいし 回折 かいせつ 法 ほう 示 しめ 種類 しゅるい 異性 いせい 体 たい 中性 ちゅうせい 型 がた 2 NSO2 (OH)、HN=SO(OH)2 、双 そう 性 せい 型 がた 3 N+ SO3 − 、H2 N+ =SO(OH)O− )のうち、H3 N+ SO3 − の構造 こうぞう 主 おも 分 わ [2] 硫黄 いおう 酸素 さんそ 硫黄 いおう 窒素 ちっそ 結合 けつごう 距離 きょり 長 なが 硫黄 いおう 窒素 ちっそ 単 たん 結合 けつごう 性 せい 短 みじか 硫黄 いおう 酸素 さんそ 二 に 重 じゅう 結合 けつごう 性 せい 持 も 示 しめ [3]
スルファミン酸 さん 比較的 ひかくてき 強酸 きょうさん 酸 さん 解離 かいり 定数 ていすう K a = 1.01 x 10−1 である。固体 こたい 吸湿 きゅうしつ 性 せい 示 しめ 純 じゅん 品 しな 得 え 酸 さん 塩基 えんき 滴 しずく 定 じょう 標準 ひょうじゅん 物質 ぶっしつ 用 もち 液体 えきたい 中 なか 段階 だんかい 脱 だつ 化 か 受 う 3 ]2− となる[4]
アミノ基 もと 電子 でんし 求 もとめ 結合 けつごう 点 てん 尿素 にょうそ 共通 きょうつう 点 てん 例 たと 水溶液 すいようえき 加熱 かねつ アンモニウム イオンを生成 せいせい
尿素 にょうそ 発煙 はつえん 硫酸 りゅうさん 反応 はんのう 生 しょう [1]
CO
(
NH
2
)
2
+
H
2
S
2
O
7
⟶
2
(
NH
2
)
HSO
3
+
CO
2
{\displaystyle {\ce {{CO(NH2)2}+ H2S2O7 -> 2{(NH2)HSO3}+ CO2}}}
亜 あ 硝酸 しょうさん 反応 はんのう 窒素 ちっそ 発生 はっせい
HNO
2
+
(
NH
2
)
HSO
3
⟶
H
2
SO
4
+
N
2
+
H
2
O
{\displaystyle {\ce {{HNO2}+ (NH2)HSO3 -> {H2SO4}+ {N2}+ H2O}}}
水酸化 すいさんか 溶液 ようえき 正確 せいかく 濃度 のうど 求 もと 標定 ひょうてい 用 もち
(
NH
2
)
HSO
3
+
NaOH
⟶
(
NH
2
)
NaSO
3
+
H
2
O
{\displaystyle {\ce {{(NH2)HSO3}+ NaOH -> {(NH2)NaSO3}+ H2O}}}
還元 かんげん 剤 ざい 硝酸 しょうさん 反応 はんのう 亜 あ 酸化 さんか 窒素 ちっそ 発生 はっせい
HNO
3
+
(
NH
2
)
HSO
3
⟶
H
2
SO
4
+
N
2
O
+
H
2
O
{\displaystyle {\ce {{HNO3}+ (NH2)HSO3 -> {H2SO4}+ {N2O}+ H2O}}}
冷水 れいすい 中 ちゅう 徐々 じょじょ 以上 いじょう 速 すみ 加水 かすい 分解 ぶんかい 硫酸 りゅうさん 水素 すいそ
(
NH
2
)
HSO
3
+
H
2
O
→
80
∘
C
NH
4
HSO
4
{\displaystyle {\ce {{(NH2)HSO3}+H2O->[80\,^{\circ }{\text{C}}]{NH4HSO4}}}}
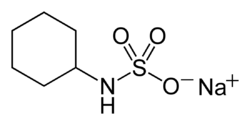
チクロ Sulfamic acid スルファミン酸 さん 人工 じんこう 甘味 あまみ 料 りょう 関連 かんれん 深 ふか 酸 さん シクロヘキシルアミン の混合 こんごう 物 ぶつ 水酸化 すいさんか 反応 はんのう 得 え チクロ はかつて安価 あんか 甘味 あまみ 料 りょう 多用 たよう 現在 げんざい 使 つか アセスルファムカリウム もまたスルファミン酸 さん 構造 こうぞう 持 も 人工 じんこう 甘味 あまみ 料 りょう 例 れい
スルファミン酸 さん 置換 ちかん 誘導体 ゆうどうたい 中 なか 抗生 こうせい 物質 ぶっしつ HIV に対 たい 逆 ぎゃく 転写 てんしゃ 阻害 そがい 薬 やく 阻害 そがい 薬 やく 抗ガン剤 こうがんざい 阻害 そがい 薬 やく 炭酸 たんさん 脱水 だっすい 酵素 こうそ 阻害 そがい 薬 やく 抗 こう 薬 やく 抗 こう 肥満 ひまん 薬 やく 用 もち
スルファミン酸 さん 酸性 さんせい 洗浄 せんじょう 剤 ざい 金属 きんぞく 洗浄 せんじょう 用 もち 塩酸 えんさん 代 か 錆 さび 落 お 湯垢 ゆあか 落 お 用 もち 更 さら 尿素 にょうそ 親和 しんわ 性 せい 利用 りよう 尿 にょう 石 せき 除去 じょきょ 剤 ざい 用 もち
ほか、エステル化 か 反応 はんのう 樹脂 じゅし 入 い 歯 ば 安定 あんてい 剤 ざい 固化 こか 進 すす 酸 さん 触媒 しょくばい 色素 しきそ 除草 じょそう 剤 ざい 合成 ごうせい 原料 げんりょう 亜 あ 硝酸 しょうさん 製造 せいぞう 水系 すいけい 消火 しょうか 剤 ざい 添加 てんか 剤 ざい 用途 ようと 知 し
^ a b 『新 しん 実験 じっけん 化学 かがく 講座 こうざ
^ R. L. Sass (April 1960). “A neutron diffraction study on the crystal structure of sulfamic acid”. Acta Crystallographica 13 (4): 320–324. doi :10.1107/S0365110X60000789 . ^ J. W. Bats, P. Coppens, T. F. Koetzle (1977). “The Experimental Charge Density in Sulfur-Containing Molecules: A Study of the Deformation Electron Density in Sulfamic Acid at 78 K by X-ray and Neutron Diffraction”. Acta Crystallographica B33 . doi :10.1107/S0567740877002568 . ^ Clapp, L. B. (1943). “Sulfamic acid and its uses”. Journal of Chemical Education 20 (4): 189–346. doi :10.1021/ed020p189 .
MSDS 総説 そうせつ Med. Res. Rev. 2005 , 25 , 186-228.総説 そうせつ 1996 . ISBN 0-471-95512-4 総説 そうせつ 1997 . ISBN 0-7506-3365-4 日本 にっぽん 化 か 学会 がっかい 編 へん 無機 むき 化合 かごう 物 ぶつ 合成 ごうせい 丸善 まるぜん 出版 しゅっぱん 新 しん 実験 じっけん 化学 かがく 講座 こうざ 年 ねん NCID BN00705318 。 








![{\displaystyle {\ce {{(NH2)HSO3}+H2O->[80\,^{\circ }{\text{C}}]{NH4HSO4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/97c1c3ec295e333e32172ea54946eee6bac0ab9c)