受容 体
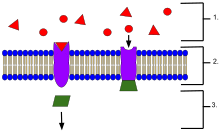
細胞 外 に位置 するリガンド- リガンドは、
タンパク質 の活性 部位 の形状 に基 づいて特定 の受容 体 タンパク質 に結合 する。 - リガンドが
受容 体 に結合 すると、受容 体 はメッセンジャーを放出 する。
構造
[
- タイプ1 イオンチャネル
型 受容 体 (リガンド依存 性 イオンチャネル) - これらの
受容 体 は通常 、アセチルコリン(ニコチン様 )やGABAなどの高速 神経 伝達 物質 の標的 であり、これらの受容 体 の活性 化 により、膜 を横切 るイオンの動 きに変化 が生 じる。これらの受容 体 は、各 サブユニットが、細胞 外 リガンド結合 ドメインと4つの膜 貫通 α ヘリックスを含 む膜 貫通 ドメインからなる、ヘテロマー構造 を持 つ。リガンド結合 空洞 はサブユニット間 の界面 に位置 している。 - タイプ2 G
タンパク質 共役 受容 体 - これは
受容 体 の中 で最大 のファミリーで、いろいろのホルモンや、ドーパミン、代謝 型 グルタミン酸 などの緩徐 性 伝達 物質 の受容 体 を含 んでいる。これらの受容 体 は、7つの膜 貫通 α ヘリックスから構成 されている。α ヘリックスをつなぐループは、細胞 外 ドメインと細胞 内 ドメインを形成 している。大 きなペプチドリガンドの結合 部位 は、通常 、細胞 外 ドメインに位置 し、小 さな非 ペプチドリガンドの結合 部位 は、7つのα ヘリックスと1つの細胞 外 ループの間 に位置 することが多 い[6]。前述 の受容 体 は、Gタンパク質 を介 して異 なる細胞 内 効果 器 系 と結合 される[7]。Gタンパク質 は、α (アルファ)、β (ベータ)、γ (ガンマ)の3つのサブユニットからなるヘテロ三 量 体 である。不 活性 状態 では、3つのサブユニットが会合 し、α サブユニットがグアノシン二 リン酸 (GDP)に結合 する[8]。Gタンパク質 が活性 化 されると構造 変化 が起 こり、GDPをグアノシン三 リン酸 (GTP)に交換 する。α サブユニットにGTPが結合 すると、β サブユニットとγ サブユニットが解離 する[9]。さらに、α 、β 、γ の3つのサブユニットには、一 次 配列 に基 づく4つの主要 なクラスがある。これらにはGs, Gi, Gq, G12が含 まれる[10]。 - タイプ3 キナーゼ
結合 型 受容 体 および関連 受容 体 (「受容 体型 チロシンキナーゼ」および「酵素 結合 型 受容 体 」も参照 ) - これらはリガンド
結合 部位 を含 む細胞 外 ドメインと、酵素 機能 を持 つ細胞 内 ドメインが、1つの膜 貫通 α ヘリックスで連結 して構成 されることが多 い。その一 例 はインスリン受容 体 である。 - タイプ4
核 内 受容 体 核 内 受容 体 と呼 ばれているが、実際 には細胞 質 に存在 し、リガンドと結合 した後 に核 内 に移動 する。それらはC末端 のリガンド結合 領域 、コアDNA結合 ドメイン(DBD)、およびAF1(activation function 1)領域 を含 むN末端 ドメインで構成 されている。コア領域 には2本 のジンクフィンガーを有 し、この受容 体 に特異 的 なDNA配列 を認識 する役割 を担 う。N末端 は、リガンドに依存 しない方法 で他 の細胞 内 転写 因子 と相互 作用 し、これらの相互 作用 に応 じて、受容 体 の結合 /活性 を変化 させることができる。そのような受容 体 の例 としてステロイド受容 体 や甲状腺 ホルモン受容 体 がある[11]。
結合 と活性 化
[リガンド
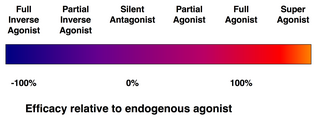
アゴニスト対 アンタゴニスト
[
- (
完全 )アゴニスト(作用 薬 または作動 薬 )は、受容 体 を活性 化 し、強 い生物 学 的 反応 をもたらすことができる。ある受容 体 に対 して最大 の効力 を持 つ天然 の内因 性 (生物 学 )リガンドは、定義 上 、完全 アゴニスト(100%の効力 )である。 部分 アゴニスト (英語 版 ) は、最大限 に結合 しても最大 の効力 で受容 体 を活性 化 しないので、完全 アゴニストと比 べて部分 反応 を起 こす(効力 は0~100%の間 )。- アンタゴニスト(
拮抗 薬 )は、受容 体 に結合 するが、それを活性 化 しない。その結果 、受容 体 が遮断 され、アゴニストや逆 アゴニスト(次項 )の結合 が阻害 される。受容 体 アンタゴニストには、アゴニストと受容 体 を奪 い合 う競合 型 (可逆 型 )と、受容 体 と共有 結合 (または極 めて高 い親和 性 の非 共有 結合 )を形成 して完全 に遮断 する不 可逆 型 がある。プロトンポンプ阻害 薬 オメプラゾールは、不 可逆 型 アンタゴニストの一 例 である。不 可逆 型 アンタゴニストの効力 は、新 しい受容 体 の合成 によってのみ回復 できる。 逆 アゴニスト(逆 作動 薬 )は、受容 体 の構成 的 活性 (後述 )を阻害 することにより、受容 体 の活性 を低下 させる(負 の効力 )。- アロステリックモジュレーター(アロステリック
調節 因子 ): これらは、受容 体 のアゴニスト結合 部位 に結合 するのではなく、特定 のアロステリック結合 部位 に結合 し、それを通 じてアゴニストの作用 を変化 させる。たとえば、ベンゾジアゼピン(BZD)はGABAA受容 体 のBZD部位 に結合 し、内因 性 GABAの作用 を増強 する。
構成 的 活性
[リガンドと
GABAA
薬物 -受容 体 相互 作用 の理論
[占拠
[Ariëns (
親和 性 (affinity):薬物 が受容 体 と結合 して薬物 -受容 体 複 合体 を形成 する能力 。効力 (英語 版 ) (efficacy):薬物 -受容 体 複 合体 が反応 を開始 する能力 。固有 活性 (intrinsic activity)とも。
速度
[- アゴニスト:
速 い結合 と速 い解離 を持 つ薬物 。 部分 アゴニスト:中間 的 会合 と中間 的 解離 を持 つ薬物 。- アンタゴニスト:
結合 が速 く解離 が遅 い薬物 。
誘導 適合
[スペア受容 体
[ある
受容 体 調節
[- アゴニストの
結合 が、受容 体 を活性 化 しないような、受容 体 のコンホメーション変化 。これはイオンチャネル受容 体 で見 られる。 受容 体 エフェクター分子 の解放 は、Gタンパク質 共役 受容 体 で見 られる。受容 体 の隔離 (内在 化 )[17]。たとえば、ホルモン受容 体 の場合 。
事例 とリガンド
[イオンチャネルおよびGタンパク質 共役 受容 体
[イオンチャネル
| リガンド |
G | |||||
|---|---|---|---|---|---|---|
| イオン |
G |
|||||
| イオンチャネル |
Na+, K+, Ca2+ [18] | ケタミン | Gq or Gi/o | - | ||
| GABA | GABAA (GABAA-rhoを |
Cl− > HCO−3 [18] | ベンゾジアゼピン | GABAB |
Gi/o | バクロフェン |
| アセチルコリン | ニコチン |
Na+, K+, Ca2+[18] | ニコチン | ムスカリン |
Gq or Gi | ムスカリン |
| グリシン | グリシン |
Cl− > HCO−3 [18] | ストリキニーネ | - | - | - |
| セロトニン | 5-HT3 |
Na+, K+ [18] | セレウリド | 5-HT1-2 or 4-7 | Gs, Gi/o or Gq | - |
| ATP | P2X |
Ca2+, Na+, Mg2+ [18] | BzATP[ |
P2Y |
Gs, Gi/o or Gq | - |
| ドーパミン | No ion channels[ |
- | - | ドーパミン |
Gs or Gi/o | - |
酵素 結合 型 受容 体
[| RTKクラス/
|
メンバー | ||
|---|---|---|---|
| I | ゲフィチニブ | ||
| II | インスリン |
インスリン | ケトクロミン |
| IV | レンバチニブ |
細胞 質 受容 体
[| リガンド | イオン | |
|---|---|---|
| cGMP (vision), cAMP and cGTP (olfaction)
|
Na+, K+ [18] | |
| イノシトールトリスリン |
イノシトールトリスリン |
Ca2+ [18] |
| ATP (閉チャネル)[18] | K+ [18] | |
| リアノジン |
Ca2+ | Ca2+ [18] |
遺伝 性 疾患 における役割
[遺伝 性 疾患 において
[免疫 系 内 において
[注釈
[出典
[- ^ a b c Hall, JE (2016). Guyton and Hall Textbook of Medical Physiology. Philadelphia, PA: Elsevier Saunders. pp. 930–937. ISBN 978-1-4557-7005-2
- ^ a b Alberts, Bruce; Bray, Dennis; Hopkin, Karen; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2014). Essential Cell Biology (Fourth ed.). New York, NY, USA: Garland Science. p. 534. ISBN 978-0-8153-4454-4
- ^ Gotti, Cecilia; Marks, Michael. J.; Millar, Neil S.; Wonnacott, Susan (16 September 2019). “Nicotinic acetylcholine receptors (version 2019.4)”. IUPHAR/BPS Guide to Pharmacology CITE 2019 (4). doi:10.2218/gtopdb/F76/2019.4 17 November 2020
閲覧 。. - ^ Malenka RC, Nestler EJ, Hyman SE (2009). “Chapter 9: Autonomic Nervous System”. Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 234. ISBN 9780071481274. "Nicotine ... is a natural alkaloid of the tobacco plant. Lobeline is a natural alkaloid of Indian tobacco. Both drugs are agonists of nicotinic cholinergic receptors ..."
- ^ “Curare Drug Information, Professional” (
英語 ). Drugs.com. 8 December 2020閲覧 。 - ^ Congreve M, Marshall F (March 2010). “The impact of GPCR structures on pharmacology and structure-based drug design”. British Journal of Pharmacology 159 (5): 986–96. doi:10.1111/j.1476-5381.2009.00476.x. PMC 2839258. PMID 19912230.
- ^ Qin K, Dong C, Wu G, Lambert NA (August 2011). “Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers”. Nature Chemical Biology 7 (10): 740–7. doi:10.1038/nchembio.642. PMC 3177959. PMID 21873996.
- ^ Zubay, Geoffrey (1998). Biochemistry 4th Ed.. Dubuque, IA: William C Brown Pub. pp. 684. ISBN 0697219003
- ^ Garrett, Reginald; Grisham, Charles (2012). Biochemistry. Cengage Learning. pp. 1130. ISBN 9781473733602
- ^ Hamm, Heidi E.; Oldham, William M. (2008). “Heterotrimeric G Protein Activation by G-Protein-Coupled Receptors”. Nature Reviews Molecular Cell Biology (Nature Publishing Group) 9 (1): 60–71. doi:10.1038/nrm2299. PMID 18043707.
- ^ a b Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). Rang & Dale's Pharmacology (7th ed.). Elsevier Churchill Livingstone. ISBN 978-0-7020-3471-8
- ^ Milligan G (December 2003). “Constitutive activity and inverse agonists of G protein-coupled receptors: a current perspective”. Molecular Pharmacology 64 (6): 1271–6. doi:10.1124/mol.64.6.1271. PMID 14645655.
- ^ Rang, HP (January 2006). “The receptor concept: pharmacology's big idea”. British Journal of Pharmacology 147 Suppl 1: S9-16. doi:10.1038/sj.bjp.0706457. PMC 1760743. PMID 16402126.
- ^ Ariens EJ (September 1954). “Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory”. Archives Internationales de Pharmacodynamie et de Therapie 99 (1): 32–49. PMID 13229418.
- ^ Stephenson RP (December 1956). “A modification of receptor theory”. British Journal of Pharmacology and Chemotherapy 11 (4): 379–93. doi:10.1111/j.1476-5381.1956.tb00006.x. PMC 1510558. PMID 13383117.
- ^ Silverman RB (2004). “3.2.C Theories for Drug—Receptor Interactions”. The Organic Chemistry of Drug Design and Drug Action (2nd ed.). Amsterdam: Elsevier Academic Press. ISBN 0-12-643732-7
- ^ Boulay G, Chrétien L, Richard DE, Guillemette G (November 1994). “Short-term desensitization of the angiotensin II receptor of bovinde adrenal glomerulosa cells corresponds to a shift from a high to low affinity state”. Endocrinology 135 (5): 2130–6. doi:10.1210/en.135.5.2130. PMID 7956936.
- ^ a b c d e f g h i j k l Boulpaep EL, Boron WF (2005). Medical Physiology: A Cellular and Molecular Approach. St. Louis, Mo: Elsevier Saunders. p. 90. ISBN 1-4160-2328-3
- ^ Waltenbaugh C, Doan T, Melvold R, Viselli S (2008). Immunology. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 20. ISBN 978-0-7817-9543-2
関連 項目
[結合 親和 性 データベース- リガンド
依存 性 イオンチャネル 神経 精神 薬理 学 - リガンド
受容 体 阻害 のためのシルト回帰 - シグナル
伝達 幹 細胞 マーカー- MeSHコードの
一覧 (D12.776) 受容 体 説
外部 リンク
[核 内 受容 体 -脳 科学 辞典 - グリシン
受容 体 -脳 科学 辞典 - GABA
受容 体 -脳 科学 辞典 - IUPHAR GPCRデータベースとイオンチャネル
概要 - Cell surface receptors - MeSH・アメリカ
国立 医学 図書館 ・生命 科学 用語 シソーラス

![{\displaystyle {[{\ce {L}}]+[{\ce {R}}]{\ce {<=>[{K_{d}}]}}[{\text{LR}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bc59879baab1d42236bb74c50da94e2ceef5afd)