硫(英語:Sulfur),是一種化學元素,化學符號为S,原子序數为16。硫是一种非常常见的无味无臭的非金属,纯的硫是黄色的晶体,又稱硫黄[註 1][4]。硫有许多不同的化合价,常見的有-2, 0, +4, +6等。在自然界中常以硫化物或硫酸盐的形式出现,尤其在火山地区纯的硫也在自然界出现。单质硫不溶于水,微溶于乙醇,易溶于二硫化碳。对所有的生物来说,硫都是一种重要的必不可少的元素,它是多种氨基酸的组成部分,尤其是大多数蛋白质的组成部分。它主要被用在肥料中,也廣泛地被用在火药、潤滑劑、殺蟲劑和抗真菌剂中。
硫 16S|
|
黄色晶体
 |
|
| 名稱·符號·序數 | 硫(Sulfur)·S·16 |
|---|
| 元素類別 | 非金屬、氧族元素 |
|---|
| 族·週期·區 | 16·3·p |
|---|
| 標準原子質量 | [32.059, 32.076][1] |
|---|
| 电子排布 | [Ne] 3s2 3p4
2, 8, 6
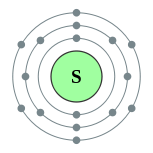 硫的电子層(2, 8, 6) 硫的电子層(2, 8, 6) |
|---|
|
| 确认其为一元素者 | 安托万-洛朗·德·拉瓦锡 (1777) |
|---|
|
| 物態 | 固體 |
|---|
| 密度 | (接近室温)
(斜方硫) 2.07 g·cm−3 |
|---|
| 密度 | (接近室温)
(单斜硫) 1.96 g·cm−3 |
|---|
| 熔点時液體密度 | 1.819 g·cm−3 |
|---|
| 熔点 | 388.36 K,115.21 °C,239.38 °F |
|---|
| 沸點 | 717.8 K,444.6 °C,832.3 °F |
|---|
| 臨界點 | 1314 K,20.7 MPa |
|---|
| 熔化热 | 1.727 kJ·mol−1 |
|---|
| 汽化热 | 45 kJ·mol−1 |
|---|
| 比熱容 | 22.75 J·mol−1·K−1 |
|---|
蒸氣壓
| 壓/Pa
|
1
|
10
|
100
|
1 k
|
10 k
|
100 k
|
| 溫/K
|
375
|
408
|
449
|
508
|
591
|
717
|
|
|
| 氧化态 | 6, 5, 4, 3, 2, 1, -1, -2
(强酸性) |
|---|
| 电负性 | 2.58(鲍林标度) |
|---|
| 电离能 | 第一:999.6 kJ·mol−1
第二:2252 kJ·mol−1
第三:3357 kJ·mol−1
(更多) |
|---|
| 共价半径 | 105±3 pm |
|---|
| 范德华半径 | 180 pm |
|---|
 硫的原子谱线 硫的原子谱线 |
|
| 晶体结构 | 正交 |
|---|
| 磁序 | 抗磁性[2] |
|---|
| 磁化率 | (α) −15.5·10−6
(298 K)[3] cm3/mol |
|---|
| 電阻率 | (20 °C)(无定形硫)
2×1015 Ω·m |
|---|
| 熱導率 | (无定形硫)
0.205 W·m−1·K−1 |
|---|
| 体积模量 | 7.7 GPa |
|---|
| 莫氏硬度 | 2.0 |
|---|
| CAS号 | 7704-34-9 |
|---|
|
主条目:硫的同位素
|
纯的硫呈浅黄色,质地柔软,轻。与氢结成有毒化合物硫化氢后有一股臭味(臭鸡蛋味)[註 2]。硫燃烧时的火焰是蓝色的,并散發出一种特别的硫磺味(二氧化硫的气味)。硫不溶于水但溶于二硫化碳。硫最常见的化学价是-2、+2、+4和+6。在所有的物态中(固态、液态和气态),硫都有不同的同素异形体,这些同素异形体的相互关系还没有被完全理解。晶体的硫可以组成一个由八个原子组成的环:S8。
硫有两种晶体形式:斜方晶八面体和单斜棱晶体,前者在室温下比较稳定。硫的熔点为118℃。
硫在工业中很重要,比如作为电池中或溶液中的硫酸。硫被用来制造黑火药。在橡胶工业中做硫化剂。硫还被用来杀真菌,用做化肥。硫化物在造纸业中用来漂白。硫酸盐在烟火中也有用途。硫代硫酸钠和硫代硫酸銨在照相中做定影剂。硫酸镁可用做润滑剂,被加在肥皂中和轻柔磨砂膏中,也可以用做肥料。
在古代人类就已经认识硫了。中国人发明的火药是硝酸钾、碳和硫的混合物。1770年代安托万·拉瓦锡证明硫是一种元素。19世纪末,英国科学家C.F.Claus发明克劳斯工艺,先将气体中的硫化氢部分氧化为二氧化硫,再让剩余硫化氢与二氧化硫反应,生成硫和水,实现了硫的大批量工业生产。
陽明山國家公園地熱氣井與硫磺
陽明山國家公園氣井的硫磺
在自然界中硫主要以硫化物(如黄铁矿)和硫酸盐(如石膏)的形式出现,在热泉和火山地区也有纯的硫存在。除此以外一些矿物如辰砂、方铅矿、闪锌矿和辉锑矿等也都是硫化物的矿物。煤和石油中也含少量硫,这是为什么在燃煤和石油时有二氧化硫被释放出来(酸雨)。今天许多国家要求燃烧煤和石油时被释放的二氧化硫要进行回收。这些被回收的硫是今天工业中使用的硫的一个重要来源。此过程通常通过一个叫做“克劳斯工艺”的过程来实现。另一个重要来源是硫矿。
在工业中,最重要的硫的化合物是硫酸。硫酸是所有工业过程中必不可少的一个原材料,因此硫酸的消耗量被看做是一个国家工业化程度的一个指标。在美国硫酸是所有生产得最多的化合物。
木卫一表面的黄色主要是它的火山释放的硫造成的。月球上阿利斯塔克环形山中比较暗的地区可能是硫形成的。在许多陨石中有硫。基於人類對外星資源的興趣強烈提升,木衛一的硫磺也曾經是研究考慮開採的對象;然而成本驚人,除了構想以外,並未付諸實行。
硫有18种同位素,其中四种是稳定的:S-32(95.02%)、S-33(0.75%)、S-34(4.21%)和S-36(0.02%),除 外,其它放射性同位素的半衰期都很短。硫-35由宇宙射线射击空气中的氩-40而导致,其半衰期为87天。
硫化物沉淀时根据温度的不同S-34的含量少许不同。假如在一个矿物中硫化物和碳酸盐同时存在的话,那么根据碳-13和硫-34的含量可以推算出矿物形成时矿水的pH值和氧的逸度。
在森林生态系统中,硫酸盐主要来自空气,少量来自矿物的风化。其中硫的同位素的不同含量可用来确定它们的来历。
在接触二硫化碳、硫化氢和二氧化硫时要非常小心。二氧化硫可以在肺中与水结合成亚硫酸,亚硫酸可以导致肺出血和窒息。硫化氢毒性非常高。虽然硫化氢的味道一开始非常强烈,但人的嗅觉很快就被它压抑了。因此受害人有可能未察觉它的存在。
- ^ 也作“硫磺”“流黄”,和“硫黄”属同音异形词,在台湾地区使用,在中国大陆为不规范写法。
- ^ 一般所謂硫的臭味其實是硫化氢或是有机硫化合物的臭味
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Lide, D. R. (编). Magnetic susceptibility of the elements and inorganic compounds. CRC Handbook of Chemistry and Physics (PDF) 86th. Boca Raton (FL): CRC Press. 2005 [2020-10-23]. ISBN 0-8493-0486-5. 原始内容存档于2011-03-03.
- ^ Weast, Robert. CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. 1984: E110. ISBN 0-8493-0464-4.
- ^ CMEX中文數位化技術推廣基金會. 辭典檢視 [硫黃 : ㄌㄧㄡˊ ㄏㄨㄤˊ] - 教育部《重編國語辭典修訂本》2021. dict.revised.moe.edu.tw (中文(臺灣)).


