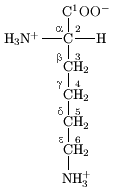蛋白 たんぱく 蛋白 たんぱく 是 ぜ 指 ゆび 蛋白 たんぱく 分子 ぶんし 的 てき 空 そら 作 さく 重要 じゅうよう 的 てき 生物 せいぶつ 大分 おおいた 子 こ 蛋白 たんぱく 要 よう 由 ゆかり 碳 、氢 、氧 、氮 、硫 等 ひとし 化学 かがく 元素 げんそ 部分 ぶぶん 蛋白 たんぱく 是 ぜ 由 よし 不同 ふどう 的 てき L型 がた α あるふぁ 酸 さん 连接形成 けいせい 的 てき 聚合物 ぶつ ,但 ただし 存在 そんざい 不 ふ 常 つね 基 もと 酸 さん 硒半胱氨酸 さん 、吡咯赖氨酸 さん ,参与 さんよ 到 いた 数 すう 的 てき 蛋白 たんぱく 合成 ごうせい 中 ちゅう 制 せい 同 どう 在 ざい 形成 けいせい 蛋白 たんぱく 酸 す 又 また 被 ひ 称 しょう 基 もと
蛋白 たんぱく 多 た 之 これ 界 かい 限 げん 是 ぜ 有人 ゆうじん 基 もと 能 のう 性 せい 作用 さよう 的 てき 结构域 いき 所 ところ 残 ざん 基数 きすう 若 わか 残 ざん 基数 きすう 少 しょう 之 の
要 よう 生物 せいぶつ 学 がく 功 こう 能 のう 蛋白 たんぱく 需要 じゅよう 正 せい 折 おり 特定 とくてい 主要 しゅよう 是 ぜ 通 どおり 量的 りょうてき 非 ひ 共 きょう 相互 そうご 作用 さよう 氢键 、离子键 、范德华力 和 わ 疏水 そすい 作用 さよう 来 らい 在 ざい 一 いち 白 しろ 特 とく 分泌 ぶんぴつ 性 せい 蛋白 たんぱく 折 おり 中 なか 雙 そう 到 いた 作用 さよう 子 こ 水平 すいへい 上 じょう 了解 りょうかい 蛋白 たんぱく 作用 さよう 机 つくえ 制 せい 常常 つねづね 需要 じゅよう 蛋白 たんぱく 三 さん 由 よし 研究 けんきゅう 蛋白 たんぱく 起 おこり 来 らい 了 りょう 结构生物 せいぶつ 学 がく ,采 さい 用 よう 了 りょう 包括 ほうかつ X射 い 体 からだ 学 がく 、核 かく 共振 きょうしん 冷 ひや 等 とう 技 わざ 解析 かいせき 蛋白 たんぱく
一定数量的残基对于发挥某一生物 せいぶつ 化学 かがく 功 こう 能 のう 是 ぜ 必要 ひつよう 的 てき 基 もと 通常 つうじょう 是 ぜ 一 いち 能 のう 性 せい 结构域 いき 大小 だいしょう 的 てき 下限 かげん 蛋白 たんぱく 小 しょう 的 てき 可 か 目前 もくぜん 的 てき 蛋白 たんぱく 平均 へいきん 在 ざい 不同 ふどう 的 てき 物 ぶつ 中有 ちゅうう 所 しょ 区 く 一般 いっぱん 基 もと 真 ま 核 かく 生物 せいぶつ 的 てき 蛋白 たんぱく 平均 へいきん 比 ひ 原核 げんかく 生物 せいぶつ [ 1] 更 さら 大 だい 的 てき 蛋白 たんぱく 合体 がったい 可 か 多 おお 蛋白 たんぱく 基 もと 形成 けいせい 数 すう 千 せん 肌 はだ 白 しろ 分子 ぶんし 形成 けいせい 蛋白 たんぱく
蛋白 たんぱく 蛋白 たんぱく 磷酸丙 へい 糖 とう (triose phosphate isomerase)。左 ひだり 全部 ぜんぶ 原子 げんし 原子 げんし 原子 げんし 原子 げんし 色 しょく 原子 げんし 色 しょく 中 ちゅう 只 ただ 主 ぬし 象 ぞう 二 に α あるふぁ 螺旋 らせん 色 しょく β べーた 折 おり 色 しょく 右 みぎ 可 か 面 めん 基 もと 酸性 さんせい 酸 さん 色 しょく 酸 さん 色 しょく 酸 さん 色 しょく 非 ひ 酸 さん 色 しょく 上面 うわつら 的 てき 包含 ほうがん 可 か 点 てん 蛋白 たんぱく 的 てき 交互 こうご 式 しき PCNA 为演示 しめせ PDB 1AXC )
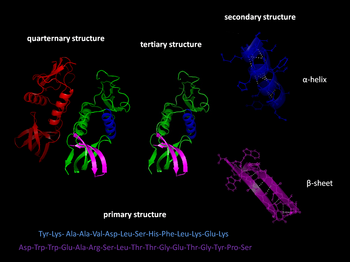
蛋白 たんぱく 蛋白 たんぱく 分子 ぶんし 可 か 述 じゅつ 不同 ふどう 的 てき 方面 ほうめん
除 じょ 了 りょう 蛋白 たんぱく 多 た 似 に 中 ちゅう 行使 こうし 生物 せいぶつ 学 がく 功 こう 能 のう 功 こう 能 のう 性 せい 的 てき 化学 かがく 称 しょう 象 ぞう
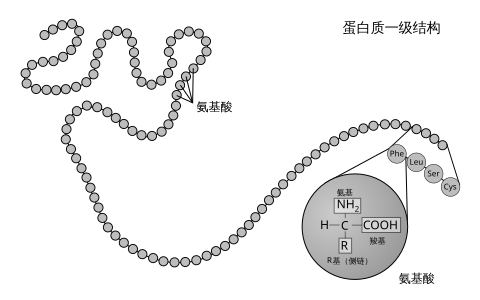
一级结构是通过共 きょう 肽键 )形成 けいせい 生物 せいぶつ 体 たい 中 ちゅう 肽键 的 てき 形成 けいせい 是 ぜ 在 ざい 蛋白 たんぱく 生物 せいぶつ 合成 ごうせい 的 てき 翻 こぼし 步 ふ 酸 さん 根 ね 据 すえ 末 まつ 端 はし 自由 じゆう 基 もと 的 てき 成分 せいぶん 分 ふん 末端 まったん 或 ある 氨基 端 はし 和 かず 末端 まったん 或 ある 羧基 端 はし 来 らい 表示 ひょうじ
定 てい 同 どう 的 てき [ 2] [ 3] [ 4] 最 さい 常用 じょうよう 的 てき 方法 ほうほう 是 ぜ 通 どおり 原子 げんし 之 の 的 てき 排列 はいれつ 方式 ほうしき 来 らい 判断 はんだん 的 てき 蛋白 たんぱく 全 ぜん 折 おり 状 じょう 可 か 到 いた
三级结构主要是通过结构“非 ひ 特 とく 相互 そうご 作用 さよう 来 らい 形成 けいせい 然 しか 只 ただ 有 ゆう 当 とう 蛋白 たんぱく 通 どおり 特 とく 相互 そうご 作用 さよう 堆 うずたか 用 よう 固定 こてい 到 いた 相 あい 位置 いち 所 しょ 形成 けいせい 的 てき 外周 がいしゅう 蛋白 たんぱく 二 に 起 おこり 到 いた 了 りょう 的 てき 作用 さよう 蛋白 たんぱく 少 しょう 出 で 二 に 因 いん 原生 げんせい 中 ちゅう 是 ぜ 不利 ふり 二 に 的 てき 形成 けいせい [ 5]
组成蛋白 たんぱく α あるふぁ 酸 さん 又 また 称 たたえ 基 もと 酸 さん 残 ざん 基 もと 表示 ひょうじ 残 ざん 基 もと 的 てき CO-R-N法 ほう α あるふぁ 酸 さん 由 よし 形成 けいせい 蛋白 たんぱく 主 ぬし 和 わ 示 しめせ α あるふぁ 原子 げんし 接着 せっちゃく 同 どう 的 てき 原子 げんし 或 ある 基 もと 一 いち 基 もと 一 いち 基 もと 一 いち 原子 げんし 中略 ちゅうりゃく 去 さ 原子 げんし 和 わ 一 いち 用 もちい 表示 ひょうじ 代表 だいひょう 各 かく 不同 ふどう 的 てき 酸 さん 的 てき 不完全 ふかんぜん 符合 ふごう 脯氨酸 さん ,其Cα あるふぁ 原子 げんし 没 ぼつ 有 ゆう 原子 げんし 被 ひ 代 だい 由 よし 接着 せっちゃく 不同 ふどう 的 てき 使 し 酸 さん 有 ゆう 了 りょう 手性 てしょう 但 ただし 大 だい 多数 たすう 蛋白 たんぱく 是 ぜ 同一 どういつ 的 てき 左手 ひだりて 型 がた 的 てき 同 どう 手性 てしょう 由 よし 没 ぼつ 有 ゆう 或 ある 者 もの 一 いち 原子 げんし 因 いん 有 ゆう 手性 てしょう 左手 ひだりて 型 がた 的 てき 酸 さん 可 か 一 いち 法 ほう 原子 げんし 在 ざい 前 まえ 来 らい 看 み α あるふぁ 原子 げんし 三 さん 顺时针 方向 ほうこう 排 はい 布 ぬの 了 りょう α あるふぁ 酸 さん 的 てき 化学 かがく 性 せい 具体 ぐたい 表 ひょう
残 ざん 基 もと 名称 めいしょう 三 さん 字母 じぼ 代 だい 单字母 はは 代 だい
相 あい 度 ど 分子 ぶんし 量 りょう pKa[ 6]
VdW 体 からだ 带电(C),疏水 そすい 性 せい
丙 へい ALA
A
13.0
71
67
H
精 せい ARG
R
5.3
157
12.5
148
C+
天 てん 冬 ふゆ ASN
N
9.9
114
96
P
天 てん 冬 ふゆ ASP
D
9.9
114
4.5
91
C-
半 はん 酸 さん CYS
C
1.8
103
8.3
86
P
谷 たに GLU
E
10.8
128
4.5
109
C-
谷 たに GLN
Q
10.8
128
114
P
甘 あま GLY
G
7.8
57
48
组氨酸 さん (Histidine)
HIS
H
0.7
137
6.8
118
P,C+
异亮氨酸 (Isoleucine)
ILE
I
4.4
113
124
H
亮 あきら LEU
L
7.8
113
124
H
赖氨酸 さん (Lysine)
LYS
K
7.0
129
11.1
135
C+
甲 きのえ 酸 さん MET
M
3.8
131
124
H
苯丙氨酸 (Phenylalanine)
PHE
F
3.3
147
135
H
脯氨酸 さん (Proline)
PRO
P
4.6
97
90
H
丝氨酸 さん (Serine)
SER
S
6.0
87
73
P
苏氨酸 さん (Threonine)
THR
T
4.6
101
93
P
色 いろ TRP
W
1.0
186
163
P
酪氨酸 さん (Tyrosine)
TYR
Y
2.2
163
9.8
141
P
缬氨酸 さん (Valine)
VAL
V
6.0
99
105
H
基 もと 化学 かがく 性 せい 不同 ふどう 可 か 天然 てんねん 酸 さん 分 ぶん 成 なり 多 た 重要 じゅうよう 的 てき 影 かげ 因子 いんし 是 ぜ 性 せい 亲 /疏水 そすい 性 せい 大小 だいしょう 等 とう 不同 ふどう 在 ざい 水溶液 すいようえき 中 ちゅう 的 てき 相互 そうご 作用 さよう 在 ざい 和 わ 蛋白 たんぱく 扮 ふん 演 えんじ 着 ぎ 重要 じゅうよう 的 てき 角 かく 色 しょく 疏水 そすい 性 せい 的 てき 包 つつみ 埋 うめ 白 しろ 部 ぶ 形成 けいせい 疏水 そすい 核心 かくしん 蛋白 たんぱく 水性 すいせい 的 てき 多 た 的 てき 是 ぜ 暴露 ばくろ 疏水 そすい 性 せい 的 てき 残 ざん 基 もと 包括 ほうかつ 亮 あきら 和 わ 酸 さん 疏水 そすい 性 せい 相 しょう 弱 じゃく 的 てき 甘 あま 丙 へい 色 いろ 和 わ 甲 かぶと 酸 さん 蛋白 たんぱく 性 せい 非常 ひじょう 重要 じゅうよう 通 つう 同 どう 之 の 形成 けいせい 定 てい 果 はて 内部 ないぶ 有 ゆう 未配 みはい 大 だい 大 だい 的 てき 性 せい 残 ざん 基 もと 有 ゆう 的 てき 性 せい 通常 つうじょう 位 い 白 しろ 面 めん 残 ざん 基 もと 有 ゆう 酸 さん 和 かず 精 きよし 有 ゆう 正 せい 残 ざん 基 もと 和 かず 天 たかし 冬 ふゆ 的 てき 酸 さん 和 わ 酸 さん 基 もと 谷 たに 天 てん 冬 ふゆ 酸 さん 之 の 的 てき 共 ども 接 せっ 形成 けいせい 二 に 酸 さん 状 じょう 象 ぞう 比 ひ 固定 こてい 甘 あま 最小 さいしょう 酸 さん 象 ぞう 最 さい 具 ぐ 可 か
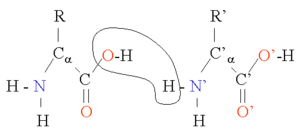
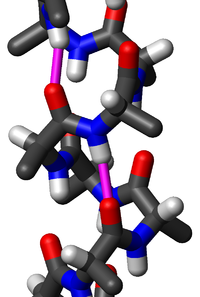
两个氨基酸 さん 通 どおり 脱水 だっすい 形成 けいせい 二 に 面 めん 角 かく φ ふぁい 和 わ ψ ぷさい 的 てき 黄色 おうしょく 部分 ぶぶん 的 てき 是 ぜ 面 めん 和 わ 分 ふん 表示 ひょうじ 左右 さゆう 残 ざん 基 もと 的 てき 两个氨基酸 さん 可 か 縮 ちぢみ 合 あい 反應 はんのう 在 ざい 一起 かずき 酸 さん 之 の 形成 けいせい 肽键 。而不断 ふだん 地 ち 重 じゅう 即 そく 多 た 反 はん 由 ゆかり 核 かく 糖 とう 体 からだ 在 ざい 翻 こぼし 中 ちゅう 所 しょ 催化 的 てき 是 ぜ 单键 ,但 ただし 具有 ぐゆう 部分 ぶぶん 的 てき 双 そう 性 せい 由 ゆかり 双 そう 的 てき π ぱい 云 うん 与 あずか 原子 げんし 上 じょう 的 てき 未 み 共用 きょうよう 共振 きょうしん 因 いん 即 そく 不能 ふのう 在 ざい 的 てき 基 もと 面 めん 上 じょう 肽平面 めん 。而对应的肽二 に 面 めん 角 かく φ ふぁい 面 めん α あるふぁ 角 かく 和 わ ψ ぷさい 面 めん α あるふぁ 1 键的旋转角 かく 有 ゆう 蛋白 たんぱく 主 ぬし 象 ぞう 随 ずい 之 の 根 ね 据 すえ 每 まい 基 もと 的 てき φ ふぁい 和 わ ψ ぷさい 来 らい 到 いた 拉 ひしげ 氏 し 由 ゆかり 形成 けいせい 同 どう 因 いん 拉 ひしげ 氏 し 辨 べん 残 ざん 基 もと 参与 さんよ 形成 けいせい 下表 かひょう 列 れつ 出 で 了 りょう 氢键 键长 的 まと 比 ひ
肽键
平均 へいきん 单键
平均 へいきん 氢键
平均 へいきん
Cα あるふぁ
153 pm
C - C
154 pm
O-H --- O-H
280 pm
C - N
133 pm
C - N
148 pm
N-H --- O=C
290 pm
N - Ca
146 pm
C - O
143 pm
O-H --- O=C
280 pm
肽或蛋白 たんぱく 酸 さん 序列 じょれつ 或 ある 残 ざん 基 もと 序列 じょれつ 被 ひ 称 しょう 蛋白 たんぱく 残 ざん 基 もと 的 てき 白 しろ 端 はし 没 ぼつ 有 ゆう 参与 さんよ 形成 けいせい 蛋白 たんぱく 可 か 定 てい 基 もと 因 いん 更 さら 准 じゅん 开放阅读框 かまち 架 か )的 てき 序列 じょれつ 来 らい 参 まいり 翻 こぼし 但 ただし 转录后 きさき 修 おさむ 和 わ 翻 こぼし 修 おさむ 二 に 形成 けいせい 磷酸化 か 和 わ 糖 とう 基 もと 化 か 等 ひとし 通常 つうじょう 被 ひ 是 ぜ 法 ほう 通 どおり 来 らい 埃 ほこり 德 とく 解法 かいほう 或 ある 连续质谱 来 らい 白 しろ 品 ひん 直接 ちょくせつ
蛋白 たんぱく α あるふぁ 螺 にし 黄色 おうしょく 点 てん 早 はや 在 ざい 年 ねん 第 だい 年 ねん 鮑 あわび 林 りん 和 かず 他 た 的 てき 同 どう 事 こと 利用 りよう 已 やめ 知的 ちてき 和 わ 提出 ていしゅつ 了 りょう α あるふぁ 螺旋 らせん 和 わ β べーた 折 おり 的 てき [ 7] α あるふぁ 螺旋 らせん 和 わ β べーた 折 おり 是 ぜ 将 はた 主 しゅ 的 てき 供 きょう 体 たい 和 わ 的 てき 一 いち 式 しき 蛋白 たんぱく 二 に 主 ぬし 架 か 即 そく 所有 しょゆう 酸 さん 的 てき 共同 きょうどう 部分 ぶぶん 解 かい 蛋白 たんぱく 随 ずい 着 ぎ 越来 ごえく 越 えつ 多 た 的 てき 蛋白 たんぱく 到 いた 解析 かいせき 更 さら 多 た 的 てき 蛋白 たんぱく 和 わ 形式 けいしき 的 てき 螺旋 らせん 蛋白 たんぱく 即 そく 二 に 面 めん 角 かく ψ ぷさい 和 わ φ ふぁい 有 ゆう 特定 とくてい 的 てき 特定 とくてい 区域 くいき 蛋白 たんぱく 和 わ 10 螺旋 らせん 等 とう 除 じょ 了 りょう 有 ゆう 的 てき 二 に 外 がい 主 しゅ 架 か 的 てき 部分 ぶぶん 称 しょう 无规则卷曲 きょく 。
从侧面 めん 看 み 一 いち α あるふぁ 螺旋 らせん 紫色 むらさきいろ 表示 ひょうじ 从羧基 もと 端 はし 看 み 一 いち α あるふぁ 螺旋 らせん 两条反 はん 平行 へいこう 的 てき β べーた 形成 けいせい 的 てき β べーた 折 おり 虚 きょ 表示 ひょうじ 箭 や 表示 ひょうじ 基 もと 端 はし 到 いた 端 はし 的 てき 方向 ほうこう
蛋白 たんぱく 元素 げんそ 之 の 各 かく 型 がた 的 てき 和 かず 相 しょう 蛋白 たんぱく 三 さん 的 てき 形成 けいせい 力 りょく 通常 つうじょう 是 ぜ 疏水 そすい 残 ざん 基 もと 的 てき 包 つつみ 埋 うめ 但 ただし 相互 そうご 作用 さよう 二 に 等 ひとし 同 どう 可 か 定 じょう 三 さん 蛋白 たんぱく 三 さん 包括 ほうかつ 所有 しょゆう 的 てき 非 ひ 共 きょう 相互 そうご 作用 さよう 不 ふ 包括 ほうかつ 二 に 蛋白 たんぱく 整体 せいたい 折 おり 蛋白 たんぱく 能 のう 来 らい 至 いたり 重要 じゅうよう 的 てき
蛋白 たんぱく 的 てき 亚基 。不 ふ 是 ぜ 所有 しょゆう 的 てき 蛋白 たんぱく 有 ゆう 四 よん 蛋白 たんぱく 可 か 单体 形式 けいしき 来 らい 功 こう 能 のう 蛋白 たんぱく 的 てき 性 せい 与 あずか 或 ある 多 た 基 もと 形成 けいせい 的 てき 物 ぶつ 是 ぜ 二 に 或 ある 二 に 体 たい 多 た 同 どう 的 てき 上 じょう 同 どう 源 みなもと 作 さく 反 たん 之 の 源 げん
赖氨酸 さん 侧链上 じょう 的 てき 原子 げんし 的 てき 命名 めいめい 残 ざん 基 もと 上 じょう 的 てき 原子 げんし 根 ね 据 すえ 希 まれ 母 はは 表 ひょう 的 てき α あるふぁ β べーた γ がんま δ でるた ε いぷしろん 等 とう 来 らい 命名 めいめい α あるふぁ 指 ゆび 的 てき 是 ぜ 残 ざん 基 もと 上 じょう 最 さい 接近 せっきん 羰基 的 てき 原子 げんし β べーた 次 じ 接近 せっきん 的 てき α あるふぁ 通常 つうじょう 被 ひ 是 ぜ 主 ぬし 架 か 的 てき 原子 げんし 原子 げんし 之 の χ かい χ かい 等 とう 来 らい 命名 めいめい 上 じょう 第 だい 一 いち 二 に 原子 げんし 即 そく α あるふぁ 和 わ β べーた 之 の 的 てき 二 に 面 めん 角 かく χ かい 可 か 多 た 不同 ふどう 的 てき 每 まい [ 8]
域 いき 模 も 体 たい 与 あずか 折 おり 型 がた [ 编辑 ] 蛋白 たんぱく 示 しめせ 蛋白 たんぱく 有 ゆう 栗色 くりいろ PH 结构域 いき 参与 さんよ phosphatidylinositol (3,4,5)-trisphosphate 绑定。蛋白 たんぱく 常 つね 所 しょ 包括 ほうかつ 域 いき 模 も 体 たい 和 かず 折 おり 尽 つき 管 かん 真 ま 核 かく 生物 せいぶつ 体 からだ 可 か 但 ただし 的 てき 域 いき 模 も 体 たい 与 あずか 折 おり 型 がた 的 てき 数量 すうりょう 得 とく 多 た 的 てき 因 いん 因 いん 或 ある 基 もと 因 いん 的 てき 一 いち 部分 ぶぶん 可 か 基 もと 因 いん 内 うち 被 ひ 加 か 倍 ばい 或 ある 移 うつり 是 ぜ 通 つう 基 もと 因 いん 重 じゅう 移 うつり 本 ほん 不 ふ 具有 ぐゆう 的 てき 蛋白 たんぱく 上 うえ 的 てき 力 りょく 可能 かのう 是 ぜ 由 よし 域 いき 的 てき 生物 せいぶつ 学 がく 功 こう 能 のう 蛋白 たんぱく 所 しょ 利用 りよう
许多蛋白 たんぱく 可 か 分 ぶん 成 なり 蛋白 たんぱく 域 いき 常 つね 独立 どくりつ 蛋白 たんぱく 需要 じゅよう 蛋白 たんぱく 他 た 部分 ぶぶん 的 てき 参与 さんよ 结构域 いき 都 みやこ 有 ゆう 自己 じこ 独特 どくとく 的 てき 生物 せいぶつ 学 がく 功 こう 能 のう 域 いき 是 ぜ 一 いち 基 もと 因 いん 或 ある 基 もと 因 いん 家族 かぞく 蛋白 たんぱく 独特 どくとく 白 しろ 共同 きょうどう 因 よし 所属 しょぞく 的 てき 蛋白 たんぱく 生物 せいぶつ 学 がく 功 こう 能 のう 中 ちゅう 占 うらない 据 すえ 地位 ちい 蛋白 たんぱく 通常 つうじょう 被 ひ 命名 めいめい 和 わ 被 ひ 出来 でき 例 れい 钙调蛋白 たんぱく 的 てき 钙 结合结构域 いき 或 ある 者 もの 初 はつ 的 てき 蛋白 たんぱく 名称 めいしょう 例 れい PDZ结构域 いき 最初 さいしょ 和 わ 由 よし 自身 じしん 可 か 定 てい 存在 そんざい 因 いん 不同 ふどう 来 き 源 げん 的 てき 域 いき 通 どおり 基 もと 因 いん 工程 こうてい 人 ひと 在 ざい 一起 かずき 形成 けいせい 融合 ゆうごう 蛋白 たんぱく
结构模 も 体 たい (structural motif)和 わ 序列 じょれつ 模 も 体 たい 是 ぜ 指 ゆび 在 ざい 大量 たいりょう 不同 ふどう 蛋白 たんぱく 被 ひ 的 てき 蛋白 たんぱく 结构模 も 体 たい 是 ぜ 由 よし 螺旋 らせん 轉 てん 角 かく 螺旋 らせん 所 しょ 又 また 被 ひ 称 しょう 超 ちょう 二 に 模 も 体 たい 往往 おうおう 含有 がんゆう 不同 ふどう 的 てき 区 く
折 おり 型 がた 的 てき 是 ぜ 整体 せいたい 的 てき 排列 はいれつ 螺旋 らせん 束 たば β べーた 桶 おけ 和 わ 罗斯曼折叠 ,或 ある 是 ぜ 由 ゆかり 蛋白 たんぱく 据 すえ 中 ちゅう 提供 ていきょう 的 てき 不同 ふどう 的 てき 折 おり [ 9]
蛋白 たんぱく 折 おり 前 まえ 的 てき 蛋白 たんぱく 又 また 称 たたえ 天然 てんねん 但 ただし 有 ゆう 同 どう 具有 ぐゆう 不同 ふどう 的 てき 生物 せいぶつ 学 がく 活性 かっせい 在 ざい 真 ま 核 かく 细胞 内 うち 蛋白 たんぱく 正 せい 需要 じゅよう 分子 ぶんし 伴 とも 的 てき
蛋白 たんぱく 后 きさき 对蛋白 しろ 行 ぎょう 分 ぶん 方法 ほうほう 有 ゆう 多 た 有 ゆう 多 た 据 すえ 包括 ほうかつ SCOP CATH 和 わ FSSP )数 すう 据 すえ 提供 ていきょう 不同 ふどう 的 てき 分 ぶん 分 ぶん 用 よう 不同 ふどう 的 てき 方法 ほうほう 分 ぶん 存 そん 放 ひ 蛋白 たんぱく PDB 数 かず 据 すえ 用 よう 了 りょう 的 てき 分 ぶん 大 だい 多数 たすう 已 やめ 分 ぶん 蛋白 たんぱく SCOP CATH 和 わ FSSP 的 まと 分 ぶん 相 しょう 同 どう 的 てき 但 ただし 在 ざい
蛋白 たんぱく 据 すえ 中 ちゅう 蛋白 たんぱく 一 いち 子 こ 按方法 ほう 和年 かずとし 定 てい 蛋白 たんぱく 速 そく 率 りつ 在 ざい 存 そん 白 しろ 核酸 かくさん 分子 ぶんし 的 てき 蛋白 たんぱく 据 すえ 中 なか 接近 せっきん 的 てき 蛋白 たんぱく 用 よう X射 い 体 からだ 学 がく 的 てき 方法 ほうほう 的 てき [ 10] 射 い 体 からだ 学 がく 可 か 定 てい 蛋白 たんぱく 分子 ぶんし 在 ざい 晶 あきら 体 たい 中 ちゅう 密度 みつど 的 てき 空 そら 分布 ぶんぷ 在 ざい 大 だい 的 てき 已 やめ 知 ち 蛋白 たんぱく 通 どおり 核 かく 共振 きょうしん 技 わざ 定 じょう [ 10] 可用 かよう 定 てい 蛋白 たんぱく 二 に 蛋白 たんぱく 圆二 に 色 しょく 性 せい 测定。振 ふ 用 よう 征 せい 多 た 蛋白 たんぱく [ 11] 二维红外光谱 已 やめ 成 なり 研究 けんきゅう 不能 ふのう 用 よう 方法 ほうほう 研究 けんきゅう 的 てき 柔 やわら 性 せい 蛋白 たんぱく 的 てき 有 ゆう 的 てき 方法 ほうほう [ 12] [ 13] 低温 ていおん 是 ぜ 近年 きんねん 来 らい 的 てき 低 てい 埃 ほこり 蛋白 たんぱく 方法 ほうほう 法 ほう 最大 さいだい 的 てき 是 ぜ 型 がた 蛋白 たんぱく 合 ごう 物 ぶつ 病毒 びょうどく 外 そと 白 しろ 核 かく 糖 とう 体 からだ 和 わ 類 るい 澱粉 でんぷん 蛋白 たんぱく 的 てき 在 ざい 具有 ぐゆう 高 だか 性 せい 的 てき 病毒 びょうどく 外 がい 膜 まく 蛋白 たんぱく 二 に 体 たい [ 14] [ 15]
近年 きんねん 来 らい 随 ずい 着 ぎ 结构基 もと 因 いん 的 てき 大量 たいりょう 的 てき 蛋白 たんぱく 得 とく 了 りょう 研究 けんきゅう 蛋白 たんぱく 作用 さよう 机 つくえ 理 り 提供 ていきょう 了 りょう 重要 じゅうよう 的 てき 信 しん 息 いき
测定蛋白 たんぱく 序列 じょれつ 比 ひ 蛋白 たんぱく 容易 ようい 得 とく 多 た 白 しろ 出 で 比 ひ 序列 じょれつ 多 た 得 とく 多 た 的 てき 能 のう 机 つくえ 制 せい 的 てき 信 しん 息 いき 因 よし 方 かた 法被 はっぴ 用 よう 序列 じょれつ
二级结构预测
三级结构预测
四级结构预测:主要 しゅよう 是 ぜ 蛋白 たんぱく 蛋白 たんぱく 相互 そうご 作用 さよう 方式 ほうしき 与 あずか 蛋白 たんぱく 有 ゆう 主要 しゅよう 分 ぶん 下 か
更 さら 多 た 可 か ExPASy Proteomics tools (页面存 そん ,存 そん 互联网档案 あん )上 じょう
^ (英文 えいぶん Brocchieri L and Karlin S. Protein length in eukaryotic and prokaryotic proteomes. Nucleic Acids Res. 2005, 33 : 3390–3400. PMID 15951512 ^ (英文 えいぶん Kabsch, W and Sander, C. A dictionary of protein secondary structure . Biopolymers. 1983, 22 : 2577–2637. ^ (英文 えいぶん Richards, FM and Kundrot, CE. Identification of structural motifs from protein coordinate data: secondary structure and first-level supersecondary structure. Proteins. 1988, 3 : 71–84. ^ (英文 えいぶん Frishman, D and Argos, P. Knowledge-based protein secondary structure assignment. Proteins. 1995, 23 : 566–579. ^ (英文 えいぶん Freedman RB, Hirst TR, Tuite MF. Protein disulphide isomerase: building bridges in protein folding. Trends Biochem Sci. 1994, 19 : 331–336. ^ (英文 えいぶん Amino Acid pKa values (页面存 そん ,存 そん 互联网档案 あん ),表 ひょう 中 ちゅう 的 てき 基 もと 酸 さん 的 てき ^ (英文 えいぶん PAULING L, COREY RB, BRANSON HR. Proc Natl Acad Sci U S A. 1951 Apr;37(4):205-11. The structure of proteins; two hydrogen-bonded helical configurations of the polypeptide chain. PMID 14816373 ^ (英文 えいぶん Protein Sidechain Conformational Analysis . [2008年 ねん 月 がつ 日 にち . (原始 げんし 内容 ないよう 存 そん 年 ねん 月 がつ 日 にち ^ Govindarajan S, Recabarren R, Goldstein RA. Estimating the total number of protein folds. . Proteins. 17 September 1999, 35 (4): 408–414 [2015-02-28 ] . PMID 10382668 doi:10.1002/(SICI)1097-0134(19990601)35:4<408::AID-PROT4>3.0.CO;2-A 原始 げんし 内容 ないよう 存 そん ^ 10.0 10.1 (英文 えいぶん PDB Current Holdings Breakdown . [2008-01-08 ] . (原始 げんし 内容 ないよう 存 そん ^ Krimm, Samuel; Bandekar, J. Vibrational Spectroscopy and Conformation of Peptides, Polypeptides, and Proteins. Advances in Protein Chemistry. Advances in Protein Chemistry. 1986, 38 (C): 181–364. ISBN 9780120342389doi:10.1016/S0065-3233(08)60528-8 ^ Lessing, J.; Roy, S.; Reppert, M.; Baer, M.; Marx, D.; Jansen, T.L.C.; Knoester, J.; Tokmakoff, A. Identifying Residual Structure in Intrinsically Disordered Systems: A 2D IR Spectroscopic Study of the GVGXPGVG Peptide. J. Am. Chem. Soc. 2012, 134 : 5032–5035. doi:10.1021/ja2114135 ^ Jansen, T.L.C.; Knoester, J. Two-dimensional infrared population transfer spectroscopy for enhancing structural markers of proteins. Biophys. J. 2008, 94 : 1818–1825. doi:10.1529/biophysj.107.118851 ^ (英文 えいぶん Branden C, Tooze J. (1999). Introduction to Protein Structure 2nd ed. Garland Publishing: New York, NY^ (英文 えいぶん Gonen T, Cheng Y, Sliz P, Hiroaki Y, Fujiyoshi Y, Harrison SC, Walz T. (2005). Lipid-protein interactions in double-layered two-dimensional AQP0 crystals. Nature 438(7068):633-8.