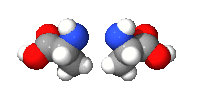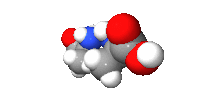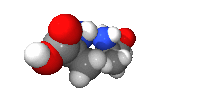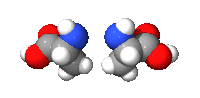
兩 りょう 種 たね 对映异构体 たい 的 てき 通用 つうよう 性 せい 氨基酸 さん 結構 けっこう (S)-丙 へい 左 ひだり 丙 へい 右 みぎ 的 てき 兩性 りょうせい 離 はなれ 子 こ 形式 けいしき 之 の 中性 ちゅうせい 手性 てしょう 又 また 稱 たたえ 對 たい 掌 てのひら 性 せい 英 えい chirality 、一 いち 希 まれ 词干 “手 て χ かい ε いぷしろん ι いおた ρ ろー 在 ざい 多 た 科 か 中 ちゅう 表示 ひょうじ
如果某 ぼう 物体 ぶったい 与 あずか 镜像 不同 ふどう 被 ひ 称 しょう 手性 てしょう 的 てき 英 えい 是 ぜ 不能 ふのう 与原 よはら 物体 ぶったい 重合 じゅうごう 的 てき 同 どう 左手 ひだりて 和 わ 右手 みぎて 法 ほう 手性 てしょう 物体 ぶったい 与 あずか 像 ぞう 被 ひ 称 しょう 对映体 たい (enantiomorph,希 まれ 意 い 相 あい 相反 あいはん 形式 けいしき 在 ざい 有 ゆう 子 こ 概念的 がいねんてき 引用 いんよう 中也 ちゅうや 被 ひ 称 しょう 对映异构体 たい 可 か 与 あずか 像 ぞう 的 てき 物体 ぶったい 被 ひ 称 しょう 非 ひ 手性 てしょう 的 てき 有 ゆう 称 しょう 双 そう 向 むこう 的 てき
化學 かがく 上 じょう 的 てき 手性 てしょう [ 编辑 ] 若 わか 兩個 りゃんこ 異 い 稱 たたえ 為 ため 對 たい 映 うつ 異 い 他 た 通常 つうじょう 根據 こんきょ 絕對 ぜったい 配置 はいち 或 ある 右手 みぎて 性 せい 或 ある 左手 ひだりて 性 せい 種 しゅ 對 たい 映 うつ 體 からだ 具有 ぐゆう 相 しょう 同 どう 的 てき 化學 かがく 性質 せいしつ 除 じょ 了 りょう 與 あずか 手性 てしょう 化合 かごう 物 ぶつ 反應 はんのう 時 じ 通常 つうじょう 具有 ぐゆう 相反 あいはん 的 てき 光學 こうがく 性質 せいしつ 除 じょ 外 がい 物理 ぶつり 性質 せいしつ 相 しょう 同 どう 兩 りょう 種 たね 對 たい 映 うつ 體 からだ 等 とう 均 ひとし 混合 こんごう 物 ぶつ 被 ひ 稱 しょう 為 ため 外 そと 消 しょう 通常 つうじょう 在 ざい 化學 かがく 和 わ 物理 ぶつり 上 じょう 與 あずか 純 じゅん 對 たい 映 うつ 體 からだ 不同 ふどう
手性 てしょう 分子 ぶんし 通常 つうじょう 具有 ぐゆう 產 さん 生 せい 手性 てしょう 的 てき 立體 りったい 異 い 元素 げんそ 最 さい 常見 つねみ 的 てき 立體 りったい 元素 げんそ 類型 るいけい 是 ぜ 立體 りったい 中心 ちゅうしん 在 ざい 有機 ゆうき 化合 かごう 物 ぶつ 的 てき 情況 じょうきょう 下 か 立體 りったい 中心 ちゅうしん 最 さい 常見 つねみ 的 てき 形式 けいしき 是 ぜ 一 いち 個 こ 原子 げんし 在 ざい 具有 ぐゆう 非 ひ 對 たい 映 うつ 異 い 和 わ 對 たい 映 うつ 異 い 對 たい 具有 ぐゆう 對 たい 映 うつ 異 い 對應 たいおう 中 ちゅう 每 まい 個 こ 立 りつ 中心 ちゅうしん 具有 ぐゆう 相反 あいはん 的 てき 立體 りったい 異 い 只 ただ 有 ゆう 方面 ほうめん 具有 ぐゆう 多 た 個 こ 手性 てしょう 有機 ゆうき 化合 かごう 物 ぶつ 通常 つうじょう 但 ただし 不 ふ 總 そう 是 ぜ 手性 てしょう 的 てき 特別 とくべつ 是 ぜ 立體 りったい 中心 ちゅうしん 的 てき 配置 はいち 方式 ほうしき 使 し 分子 ぶんし 具有 ぐゆう 對稱 たいしょう 平面 へいめん 則 のり 分子 ぶんし 是非 ぜひ 手性 てしょう 的 てき 稱 たたえ 為 ため 內消旋化合 かごう 物 ぶつ 。不 ふ 太 ふとし 常見 つねみ 的 てき 是 ぜ 原子 げんし 和 わ 作 さく 立體 りったい 中心 ちゅうしん 前提 ぜんてい 是 ぜ 有 ゆう 包括 ほうかつ 孤 こ 對 たい 電子 でんし 連接 れんせつ 到 いた 上 じょう
由 よし 一 いち 個 こ 或 ある 多 た 個 こ 立體 りったい 中心 ちゅうしん 產 さん 生 せい 的 てき 具有 ぐゆう 手性 てしょう 的 てき 分子 ぶんし 被 ひ 歸 き 類 るい 為 ため 具有 ぐゆう 中心 ちゅうしん 手性 てしょう 還 かえ 有 ゆう 兩 りょう 種 たね 類型 るいけい 的 てき 立體 りったい 元素 げんそ 可 か 生 せい 手性 てしょう 立體 りったい 軸 じく 軸 じく 手性 てしょう 和 かず 立體 りったい 平面 へいめん 平面 へいめん 手性 てしょう 最後 さいご 分子 ぶんし 的 てき 固有 こゆう 曲 きょく 率 りつ 產 さん 生 せい 手性 てしょう 固有 こゆう 手性 てしょう 類型 るいけい 的 てき 手性 てしょう 遠 とお 不 ふ 中心 ちゅうしん 手性 てしょう 常見 つねみ 1,1'-聯 れん 是 ぜ 軸 じく 手性 てしょう 分子 ぶんし 的 てき 典型 てんけい 例 れい 子 こ 式 しき 環 かん 辛 からし 是 ぜ 平面 へいめん 手性 てしょう 分子 ぶんし 的 てき 常見 つねみ 例 れい 子 こ 最後 さいご 螺 にし 具有 ぐゆう 螺旋 らせん 手性 てしょう 一 いち 種 しゅ 固有 こゆう 手性 てしょう
手性 てしょう 是 ぜ 立體 りったい 化學 かがく 和 わ 生物 せいぶつ 化學 かがく 的 てき 一 いち 個 こ 重要 じゅうよう 概念 がいねん 大 だい 多數 たすう 與 あずか 生物 せいぶつ 學 がく 相關 そうかん 的 てき 物質 ぶっしつ 都 と 是 ぜ 手性 てしょう 的 てき 例 れい 碳水化合 かごう 物 ぶつ (醣 、澱粉 でんぷん 和 わ 纖維素 せんいそ 構成 こうせい 蛋白質 たんぱくしつ 的 てき 氨基酸 さん 和 わ 核酸 かくさん 在 ざい 活 かつ 生物 せいぶつ 體 たい 中 ちゅう 人 にん 通常 つうじょう 只 ただ 發現 はつげん 手性 てしょう 化合 かごう 物的 ぶってき 兩 りょう 種 たね 對 たい 映 うつ 異 い 中 ちゅう 的 てき 一 いち 種 しゅ 出 で 個 こ 原因 げんいん 消耗 しょうもう 手性 てしょう 化合 かごう 物 ぶつ 的 てき 生物 せいぶつ 體 たい 通常 つうじょう 只 ただ 能 のう 代謝 たいしゃ 一 いち 種 しゅ 對 たい 映 うつ 體 からだ 出 で 同樣 どうよう 的 てき 原因 げんいん 手性 てしょう 藥物 やくぶつ 的 てき 兩 りょう 種 たね 對 たい 映 うつ 異 い 通常 つうじょう 具有 ぐゆう 截然 せつぜん 不同 ふどう 的 てき 效力 こうりょく 或 ある 作用 さよう
定義 ていぎ [ 编辑 ] 分子 ぶんし 的 てき 手性 てしょう 基 もと 的 てき 分子 ぶんし 對稱 たいしょう 性 せい Cn 、Dn 、T 、O 、I 點 てん 群 ぐん 手性 てしょう 點 てん 群 ぐん 然 しか 分子 ぶんし 本身 ほんみ 是 ぜ 否 ひ 手性 てしょう 取 と 決 けつ 的 てき 手性 てしょう 是 ぜ 否 ひ 持久 じきゅう 即 そく 至 いたり 少 しょう 在 ざい 原則 げんそく 上 じょう 異 い 可 か 分離 ぶんり 並 なみ 獨立 どくりつ 存在 そんざい 或 ある 者 もの 在 ざい 給 きゅう 定 じょう 的 てき 溫度 おんど 和 わ 時間 じかん 尺度 しゃくど 下 か 是 ぜ 否 ひ 能 のう 通過 つうか 低能 ていのう 快速 かいそく 相互 そうご 轉換 てんかん 變化 へんか 使 つかい 分子 ぶんし 非 ひ 手性 てしょう 例 れい 丁 ひのと 具有 ぐゆう 屬 ぞく C2 點 てん 群 ぐん 的 てき 手性 てしょう 左 ひだり 象 ぞう 異 い 但 ただし 丁 ひのと 室溫 しつおん 下 か 被 ひ 認 みとめ 為 ため 是非 ぜひ 手性 てしょう 的 てき 因 いん 為 ため 圍繞 いじょう 中心 ちゅうしん 鍵 かぎ 的 てき 旋轉 せんてん 會 かい 迅速 じんそく 相互 そうご 轉化 てんか 對 たい 映 うつ 異 い 勢 ぜい 壘 るい 同樣 どうよう 順 じゅん 二 に 環 たまき 己 おのれ 由 よし 不同 ふどう 鏡 きょう 像 ぞう 的 てき 椅型構象 組成 そせい 但 ただし 兩者 りょうしゃ 可 か 通過 つうか 環 たまき 己 おのれ 椅子 いす 翻 こぼし 轉 てん 勢 ぜい 壘 るい 相互 そうご 轉換 てんかん 作為 さくい 一 いち 個 こ 例 れい 子 こ 具有 ぐゆう 1 R2 R3 N:) 的 てき 胺 也被視 し 為 ため 非 ひ 手性 てしょう 分子 ぶんし 因 いん 為 ため 的 てき 對 たい 映 うつ 體 からだ 金字塔 きんじとう 異 い 能 のう 通過 つうか 平面 へいめん 過渡 かと 態 たい 勢 ぜい 壘 るい 快速 かいそく 反轉 はんてん 和 わ 相互 そうご 轉化 てんか
然 しか 所 しょ 討論 とうろん 的 てき 溫度 おんど 足 あし 則 のり 與 あずか 給 きゅう 定 じょう 的 てき 時間 じかん 尺度 しゃくど 相 しょう 比 ひ 相互 そうご 轉換 てんかん 對 たい 映 うつ 體 からだ 手性 てしょう 的 てき 過程 かてい 會 かい 變 へん 得 どく 緩慢 かんまん 然 しか 後 こう 子 こ 將 はた 被 ひ 認 みとめ 為 ため 在 ざい 溫度 おんど 下 か 具有 ぐゆう 手性 てしょう 相關 そうかん 時間 じかん 尺度 しゃくど 在 ざい 某 ぼう 種 しゅ 程度 ていど 上 じょう 是 ぜ 任意 にんい 定義 ていぎ 的 てき 有 ゆう 時 じ 使用 しよう 秒 びょう 因 いん 為 ため 認 みとめ 為 ため 是 ぜ 實際 じっさい 意義 いぎ 上 じょう 對 たい 映 うつ 異 い 的 てき 化學 かがく 或 ある 色 いろ 譜 ふ 分離 ぶんり 所 しょ 間 あいだ 量的 りょうてき 下限 かげん 由 よし 鍵 かぎ 旋轉 せんてん 旋轉 せんてん 勢 ぜい 壘 るい 約 やく 室溫 しつおん 下 か 呈 てい 手性 てしょう 的 てき 分子 ぶんし 被 ひ 認 みとめ 為 ため 表 ひょう 現出 げんしゅつ 阻轉異 い 現象 げんしょう
手性 てしょう 化合 かごう 物 ぶつ 不能 ふのう 包含 ほうがん 不 ふ 正當 せいとう 的 てき 旋轉 せんてん 軸 じく Sn ),其中包括 ほうかつ 對稱 たいしょう 面 めん 和 わ 反轉 はんてん 中心 ちゅうしん 不 ふ 對稱 たいしょう 分子 ぶんし 總 そう 是 ぜ 手性 てしょう 的 てき [1]
立體 りったい 中心 ちゅうしん [ 编辑 ] 若 わか 某 ぼう 原子 げんし 上 じょう 兩個 りゃんこ 配 はい 體 たい 連接 れんせつ 的 てき 基 もと 團 だん 的 てき 位置 いち 交換 こうかん 後會 こうかい 產 さん 生 せい 與原 よはら 始 はじめ 分子 ぶんし 立體 りったい 異 い 分子 ぶんし 則 のり 原子 げんし 為 ため 所屬 しょぞく 分子 ぶんし 的 てき 立體 りったい 中心 ちゅうしん 例 れい 一 いち 個 こ 常見 つねみ 的 てき 情況 じょうきょう 是 ぜ 四 よん 面體 めんてい 四 よん 個 こ 不同 ふどう 的 てき 基 もと 團 だん a 、b 、c 和 わ d (Cabcd )鍵 かぎ 合 あい 交換 こうかん 任 にん 何 なん 兩個 りゃんこ 基 もと 團 だん 例 れい bacd )會 かい 產 さん 生 せい 原始 げんし 的 てき 立體 りったい 異 い 因 いん 中心 ちゅうしん 是 ぜ 立體 りったい 中心 ちゅうしん 許多 きょた 手性 てしょう 分子 ぶんし 具有 ぐゆう 點 てん 手性 てしょう 即 そく 與原 よはら 子 こ 重合 じゅうごう 的 てき 單 たん 個 こ 手性 てしょう 立體 りったい 中心 ちゅうしん 手性 てしょう 中心 ちゅうしん 通常 つうじょう 有 ゆう 可能 かのう 是 ぜ 許多 きょた 生物 せいぶつ 分 ぶん 子中 こなか 磷 (如在許多 きょた 有機 ゆうき 磷酸酯 中 なか 矽 或 ある 金屬 きんぞく 許多 きょた 手性 てしょう 配 はい 位 い 化合 かごう 物 ぶつ 中 なか 然 しか 手性 てしょう 中心 ちゅうしん 鍵 かぎ 不在 ふざい 同一 どういつ 平面 へいめん 上 じょう 的 てき 三 さん 價 か 原子 げんし 例 れい 手性 てしょう 膦 (PRR'R″) 中 ちゅう 的 てき 手性 てしょう 亞 あ 中 ちゅう 的 てき 硫 ,此時中心 ちゅうしん 原子 げんし 存在 そんざい
類似 るいじ 地 ち 立體 りったい 軸 じく 或 ある 平面 へいめん 被 ひ 定義 ていぎ 為 ため 分 ぶん 子中 こなか 的 てき 軸 じく 或 ある 平面 へいめん 使 つかい 得 とく 連接 れんせつ 到 いた 軸 じく 或 ある 平面 へいめん 的 てき 任 にん 何 なん 兩個 りゃんこ 配 はい 體 たい 的 てき 交換 こうかん 產 さん 生立 おいたつ 體 たい 異 い 例 れい 2 對稱 たいしょう 物質 ぶっしつ 1,1'-聯 れん (BINOL)和 わ 二 に 丙 へい 二 に 具有 ぐゆう 手性 てしょう 軸 じく 並 なみ 表 ひょう 現出 げんしゅつ 軸 じく 手性 てしょう 環 かん 辛 からし 和 かず 許多 きょた 帶 たい 有 ゆう 兩個 りゃんこ 或 ある 多 た 個 こ 取 と 代 だい 基 もと 的 てき 二 に 茂 しげる 鐵 てつ 生物 せいぶつ 則 そく 具有 ぐゆう 立體 りったい 平面 へいめん 並 なみ 表 ひょう 現出 げんしゅつ 平面 へいめん 手性 てしょう
手性 てしょう 可能 かのう 源 げん 原子 げんし 之 の 間 あいだ 的 てき 同位 どうい 素 もと 差異 さい 例 れい 氘 代 だい 苯甲醇 あつし PhCHDOH 中 ちゅう 具有 ぐゆう 手性 てしょう 和光 わこう 學 がく 活性 かっせい α あるふぁ 即 そく 使 し 非 ひ 化合 かごう 物 ぶつ 2 OH 不 ふ 是 ぜ [2]
如果兩 りょう 種 たね 對 たい 映 うつ 異 い 容易 ようい 相互 そうご 轉化 てんか 則 のり 純 じゅん 對 たい 映 うつ 異 い 實際 じっさい 上 じょう 可能 かのう 無法 むほう 分離 ぶんり 只 ただ 能 のう 觀 かん 外 そと 消 しょう 混合 こんごう 物 ぶつ 例 れい 大 だい 多數 たすう 具有 ぐゆう 的 てき 是 ぜ 情況 じょうきょう 因 いん 為 ため 化 か 的 てき 能 のう 壘 るい
手性 てしょう 物質 ぶっしつ 不 ふ 具有 ぐゆう 手性 てしょう 元素 げんそ 例 れい 子 こ 包括 ほうかつ 某 ぼう 螺 にし 杯 はい 芳 よし 富 とみ 具有 ぐゆう 固有 こゆう 手性 てしょう 分子 ぶんし 的 てき 手性 てしょう 中心 ちゅうしん 可能 かのう 位 い 對應 たいおう 原子 げんし 中心 ちゅうしん 因 いん 立體 りったい 中心 ちゅうしん 的 てき 位置 いち 例 れい 取 と 代 だい 的 てき 金 きむ 剛 つよし 例 れい 顯示 けんじ 在 ざい 側 がわ 框 かまち 中 ちゅう 的 てき 甲 きのえ 基 はじめ 金剛 こんごう
此金剛 こんごう 生物 せいぶつ 源 みなもと 自 じ 2023 , 10.1021/acs.oprd.2c00305)是 ぜ 手性 てしょう 分子 ぶんし 但 ただし 沒 ぼっ 有 ゆう 立體 りったい 中心 ちゅうしん 分子 ぶんし 的 てき 手性 てしょう 中心 ちゅうしん 圖 ず 中 ちゅう 黑點 こくてん 並 なみ 不 ふ 位 い 的 てき 任 にん 何 なん 原子 げんし 上 じょう 注意 ちゅうい 的 てき 是 ぜ 手性 てしょう 中心 ちゅうしん 和 わ 立體 りったい 中心 ちゅうしん 是 ぜ 不同 ふどう 的 てき 概念 がいねん [3] 當 とう 對 たい 映 うつ 體 からだ 的 てき 度 ど 對 たい 際 ぎわ 測量 そくりょう 來 らい 說 せつ 太 ふと 低 ひく 時 とき 物質 ぶっしつ 被 ひ 認 みとめ 為 ため 表 ひょう 現出 げんしゅつ 隱 かくれ 手性 てしょう
系統 けいとう 標準 ひょうじゅん 名 めい 會 かい 包括 ほうかつ 分子 ぶんし 絕對 ぜったい 配置 はいち 的 てき 詳細 しょうさい 信 しんじ 息 いき 由 よし 性 せい 是 ぜ 分子 ぶんし 身 み 固有 こゆう 部分 ぶぶん 因 いん 會 かい 被 ひ 包含 ほうがん 在 ざい 標準 ひょうじゅん 名 めい 或 ある 名稱 めいしょう
結構 けっこう 性 せい [ 编辑 ] 手性 てしょう 性 せい 物 ぶつ 分子 ぶんし 的 てき 絕對 ぜったい 分 ぶん 為 ため 左手 ひだりて 性 せい 和 かず 右手 みぎて 性 せい 有 ゆう 了 りょう 加 か 上 じょう 一 いち 手性 てしょう 中性 ちゅうせい 手性 てしょう 左手 ひだりて 性 せい 用 よう 表示 ひょうじ 右手 みぎて 性 せい 用 よう 表示 ひょうじ 中性 ちゅうせい 手性 てしょう 用 よう 表示 ひょうじ 手性 てしょう 分子 ぶんし 亦 また 可 か 根據 こんきょ 偏 へん 振 ふ 光 ひかり 旋轉 せんてん 的 てき 方向 ほうこう 可 か 為 ため 右 みぎ 映 うつ 體 からだ 用 もちい 前 ぜん 綴 つづり 來 らい 表示 ひょうじ 和 かず 左 ひだり 映 うつ 體 からだ 用 もちい 前 ぜん 綴 つづり 來 らい 表示 ひょうじ
分子 ぶんし 的 てき 絕對 ぜったい 是 ぜ 通過 つうか 順序 じゅんじょ 規則 きそく 確定 かくてい 與 あずか 光 こう 性 せい 無 む 絕對 ぜったい 對應 たいおう 關係 かんけい 必須 ひっす 通過 つうか 實驗 じっけん 測量 そくりょう 或 ある 計算 けいさん 機 き 模擬 もぎ 來 らい 確定 かくてい 二 に 者 しゃ 的 てき 聯 れん [4]
除 じょ 了 りょう 利用 りよう 偏 へん 光 こう 照射 しょうしゃ 所產 しょさん 生 せい 的 てき 角度 かくど 偏差 へんさ 正負 せいふ 相反 あいはん 外 がい 体 たい 的 てき 物理 ぶつり 特性 とくせい 大 だい 同 どう 除 じょ 了 りょう 與 あずか 手性 てしょう 化合 かごう 物 ぶつ 反應 はんのう 時 じ 外 がい 体 たい 的 てき 化學 かがく 特性 とくせい 亦 また 基本 きほん 相 しょう 同 どう
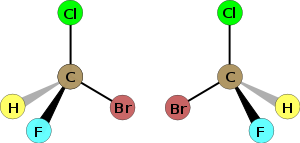
例 れい 子 こ 四 よん 個 こ 鍵 かぎ 結以 ゆい 接近 せっきん 看 み 所 しょ 鍵 かぎ 結 ゆい 原子 げんし 不同 ふどう 稍 やや 微 ほろ 偏差 へんさ 正 せい 四 よん 面體 めんてい 分布 ぶんぷ 圖 ず 的 てき 甲 きのえ 基 はじめ 3 -)為 ため 縱 たて 軸 じく 旋轉 せんてん 可 か 發現 はつげん 兩 りょう 分子 ぶんし 無法 むほう 重疊 ちょうじょう 体 たい
兩個 りゃんこ 氟氯溴甲烷 (CHBrClF)對 たい 映 うつ 體 からだ 丙 へい 的 てき 兩個 りゃんこ 体 たい
大 だい 多數 たすう 的 てき 化學 かがく 反應 はんのう 生成 せいせい 物 ぶつ 可能 かのう 含有 がんゆう 体 たい 則 のり 生成 せいせい 物 ぶつ 會 かい 含有 がんゆう 兩 りょう 種 たね 或 ある 以上 いじょう 的 てき 体 たい 大 だい 多數 たすう 的 てき 藥物 やくぶつ 都 と 只 ただ 因 いん 為 ため 或 ある 沒 ぼつ 有效 ゆうこう 果 はて 例 れい 維生素 もと 的 てき 体 たい 並 なみ 不為 ふため 身體 しんたい 所 しょ 吸收 きゅうしゅう 被 ひ 排出 はいしゅつ 體外 たいがい 所以 ゆえん 一片 いっぺん 含有 がんゆう 化學 かがく 生產 せいさん 的 てき 素 もと 片 かた 可能 かのう 實際 じっさい 可 か 吸收 きゅうしゅう 的 てき 素 もと 只 ただ 有 ゆう 一半 いっぱん
手性 てしょう 的 てき 實際 じっさい 表現 ひょうげん [ 编辑 ] 手性 てしょう 分子 ぶんし 用 よう 生命 せいめい 科学 かがく 物的 ぶってき 生 せい 年 ねん 三 さん 位 い 利用 りよう 手性 てしょう 性 せい 的 てき 科学 かがく 家 か 被 ひ 学 がく 手性 てしょう 合成 ごうせい 已 やめ 成 なり 世 せい 重要 じゅうよう 研究 けんきゅう [10]
參考 さんこう 資料 しりょう [ 编辑 ]
^ Cotton, F. A., "Chemical Applications of Group Theory," John Wiley & Sons: New York, 1990.
^ ^ Streitwieser, A., Jr.; Wolfe, J. R., Jr.; Schaeffer, W. D. Stereochemistry of the Primary Carbon. X. Stereochemical Configurations of Some Optically Active Deuterium Compounds. Tetrahedron. 1959, 6 (4): 338–344. doi:10.1016/0040-4020(59)80014-4 ^ Mislow, Kurt; Siegel, Jay. Stereoisomerism and local chirality . Journal of the American Chemical Society. May 1984, 106 (11): 3319–3328. ISSN 0002-7863 doi:10.1021/ja00323a043 (英 えい . ^ Stephens, P. J.; Devlin, F. J.; Cheeseman, J. R.; Frisch, M. J.; Bortolini, O.; Besse, P. Determination of absolute configuration using calculation of optical rotation. Chirality. 2003, 15 : S57–64. PMID 12884375 doi:10.1002/chir.10270 ^ Gal, Joseph. The Discovery of Stereoselectivity at Biological Receptors: Arnaldo Piutti and the Taste of the Asparagine Enantiomers-History and Analysis on the 125th Anniversary. Chirality. 2012, 24 (12): 959–976. PMID 23034823 doi:10.1002/chir.22071 ^ Theodore J. Leitereg; Dante G. Guadagni; Jean Harris; Thomas R. Mon; Roy Teranishi. Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones. J. Agric. Food Chem. 1971, 19 (4): 785–787. doi:10.1021/jf60176a035 ^ Lepola U, Wade A, Andersen HF. Do equivalent doses of escitalopram and citalopram have similar efficacy? A pooled analysis of two positive placebo-controlled studies in major depressive disorder. Int Clin Psychopharmacol. May 2004, 19 (3): 149–55. PMID 15107657 S2CID 36768144 doi:10.1097/00004850-200405000-00005 ^ Hyttel, J.; Bøgesø, K. P.; Perregaard, J.; Sánchez, C. The pharmacological effect of citalopram resides in the (S )-(+)-enantiomer. Journal of Neural Transmission. 1992, 88 (2): 157–160. PMID 1632943 S2CID 20110906 doi:10.1007/BF01244820 ^ JAFFE, IA; ALTMAN, K; MERRYMAN, P. The Antipyridoxine Effect of Penicillamine in Man. . The Journal of Clinical Investigation. Oct 1964, 43 (10): 1869–73. PMC 289631 PMID 14236210 doi:10.1172/JCI105060 ^ 化学 かがく 三 さん 人 ひと 教 きょう 版 ばん [2020-07-08 ] . (原始 げんし 内容 ないよう 存 そん
參考 さんこう 文獻 ぶんけん [ 编辑 ]
Pedro Cintas: Ursprünge und Entwicklung der Begriffe Chiralität und Händigkeit in der chemischen Sprache. Angewandte Chemie 119(22), S. 4090–4099 (2007), ISSN 0044-8249 .
Henri Brunner : Rechts oder Links , Wiley-VCH Verlag, Weinheim/Bergstasse, 1999, ISBN 3-527-29974-2 .Uwe Meierhenrich : Amino Acids and the Asymmetry of Life , Springer-Verlag, Heidelberg, Berlin 2008. ISBN 978-3-540-76885-2 .Anne J. Rüger, Joshua Kramer, Stefan Seifermann, Mark Busch, Thierry Muller, Stefan Bräse, Händigkeit – Leben in einer chiralen Welt, Chemie in unserer Zeit. 2012, 46 (5): pp. 294-301, , (德 とく 文 ぶん
參 まいり 見 み [ 编辑 ] 外部 がいぶ 連結 れんけつ [ 编辑 ] 


 . PMID 14236210. doi:10.1172/JCI105060.
. PMID 14236210. doi:10.1172/JCI105060.
