重 氮盐

合成 [编辑]
氟
反 应[编辑]
重 氮偶聯 反應 [编辑]
以重氮苯


取 代 反應 [编辑]
| Sandmeyer |
 |
| Gattermann |
氯化苯基 |
| Gomberg-Bachmann |

 其中Z |
| Schiemann |
 |
| Craig |
2-氨基吡啶 |
| 碘代 |
Meerwein芳 基 化 反 应[编辑]

雜 環 合成 [编辑]
| Bamberger |
 |
| Widman-Stoermer |
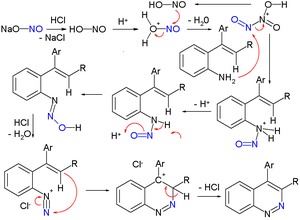 |
水 解 [编辑]
- [C6H5N2]+ + H2O → C6H5OH + N2 + H+
還 原 [编辑]
安全 [编辑]
参 见[编辑]
注釋 [编辑]
- ^ “
重 ”音 “虫 ”,chóng,意思 为“双 。”
参考 资料[编辑]
- ^ Klaus Hunger, Peter Mischke, Wolfgang Rieper, et al. "Azo Dyes" in Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a03_245.
- ^ Mihelač, M.; Siljanovska, A.; Košmrlj, J. A convenient approach to arenediazonium tosylates. Dyes Pigm. 2021, 184: 108726. doi:10.1016/j.dyepig.2020.108726
 .
.
- ^ Filimonov, Victor D.; Trusova, Marina; Postnikov, Pavel; Krasnokutskaya, Elena A.; Lee, Young Min; Hwang, Ho Yun; Kim, Hyunuk; Chi, Ki-Whan. Unusually Stable, Versatile, and Pure Arenediazonium Tosylates: Their Preparation, Structures, and Synthetic Applicability. Organic Letters. 2008-09-18, 10 (18): 3961–3964. ISSN 1523-7060. PMID 18722457. doi:10.1021/ol8013528 (
英 语). - ^ Klaus Hunger; Peter Mischke; Wolfgang Rieper; Roderich Raue; Klaus Kunde; Aloys Engel, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a03_245
- ^ Khazaei; et al. azo amine coupling giving triazenes, and triazene's decomposition giving diazonium salt. Synlett. 2012, 23 (13): 1893–1896. doi:10.1055/s-0032-1316557.
- ^ Traugott Sandmeyer. Ueber die Ersetzung der Amidgruppe durch Chlor in den aromatischen Substanzen. Berichte der deutschen chemischen Gesellschaft. 1884, 17 (3): 1633–1635 [2023-08-05]. doi:10.1002/cber.18840170219. (
原始 内容 存 档于2023-03-14). - ^ Traugott Sandmeyer. Ueber die Ersetzung der Amid-gruppe durch Chlor, Brom und Cyan in den aromatischen Substanzen. Berichte der Deutschen Chemischen Gesellschaft. 1884, 17 (4): 2650–2653 [2023-08-05]. doi:10.1002/cber.188401702202. (
原始 内容 存 档于2023-03-14). - ^ Ludwig Gattermann. Untersuchungen über Diazoverbindungen. Berichte der Deutschen Chemischen Gesellschaft. 1890, 23 (1): 1218–1228 [2023-08-05]. doi:10.1002/cber.189002301199. (
原始 内容 存 档于2012-03-29). - ^ J. K. Kochi. The Mechanism of the Sandmeyer and Meerwein Reactions. J. Am. Chem. Soc. 1957, 79 (11): 2942–2948. doi:10.1021/ja01568a066.
- ^ H. H. Hodgson. The Sandmeyer Reaction. Chem. Rev. 1947, 40 (2): 251–277. PMID 20291034. doi:10.1021/cr60126a003.
- ^ Nonhebel, D. C.; Waters, W. A. A Study of the Mechanism of the Sandmeyer Reaction. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 8 October 1957, 242 (1228): 16–27. Bibcode:1957RSPSA.242...16N. S2CID 97536209. doi:10.1098/rspa.1957.0150.
- ^ Galli, Carlo. Radical reactions of arenediazonium ions: An easy entry into the chemistry of the aryl radical. Chemical Reviews. August 1988, 88 (5): 765–792. doi:10.1021/cr00087a004.
- ^ Anslyn, Eric V. Modern physical organic chemistry. Dougherty, Dennis A., 1952-. Sausalito, CA: University Science. 2006. ISBN 978-1891389313. OCLC 55600610.
- ^ C., Vollhardt, K. Peter. Organic chemistry : structure and function. Schore, Neil Eric, 1948- 8e. New York. 2018-01-29. ISBN 9781319079451. OCLC 1007924903.
- ^ Carey, Francis A. Advanced organic chemistry. Part B, Reactions and synthesis. Sundberg, Richard J., 1938- 5th. New York, NY: Springer. 2007. ISBN 9781601195494. OCLC 223941000.
- ^ L. Gattermann. Untersuchungen über Diazoverbindungen. Berichte der Deutschen Chemischen Gesellschaft. 1894, 23 (1): 1218–1228 [2023-08-05]. doi:10.1002/cber.189002301199. (
原始 内容 存 档于2012-03-29). - ^ Gomberg, M.; Bachmann, W. E. The Synthesis of Biaryl Compounds by Means of the Diazo Reaction. J. Am. Chem. Soc. 1924, 42 (10): 2339–2343. doi:10.1021/ja01675a026.
- ^ W. Pötsch. Lexikon bedeutender Chemiker (VEB Bibliographisches Institut Leipzig, 1989) (ISBN 3817110553)
- ^ Smith, Michael B.; March, Jerry, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure 6th, New York: Wiley-Interscience, 2007, ISBN 978-0-471-72091-1
- ^ R. Pschorr. Neue Synthese des Phenanthrens und seiner Derivate. Chem. Ber. 1896, 29 (1): 496–501. doi:10.1002/cber.18960290198.
- ^ March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and Structure, third Edition, John Wiley & Sons. ISBN 0-471-85472-7.
- ^ Günther Balz, Günther Schiemann. Über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung. Ber. 1927, 5 (60): 1186–1190. doi:10.1002/cber.19270600539.
- ^ Roe, A. Org. React. 1949, 5, 193.(综述)
- ^ Flood, D. T. (1943). "Fluorobenzene". Org. Synth.; Coll. Vol. 2: 295.
- ^ (1943) "p-Fluorobenzoic Acid". Org. Synth.; Coll. Vol. 2: 299.
- ^ A Study of the Preparation of Alpha-Pyridyl Halides from Alpha-Aminopyridine by the Diazo Reaction Lyman C. Craig J. Am. Chem. Soc.; 1934; 56(1); 231-232. doi:10.1021/ja01316a072
- ^ Lucas, H. J.; Kennedy, E. R. Iodobenzene. Org. Synth. 1939, 19: 55. doi:10.15227/orgsyn.019.0055.
- ^ Meerwein, H;, Buchner, E.; van Emsterk, K. J. Prakt. Chem. 1939, 152, 237.
- ^ Minireview Intermolecular Olefin Functionalisation Involving Aryl Radicals Generated from Arenediazonium Salts Markus R. Heinrich doi:10.1002/chem.200801306 Chemistry - A European Journal 2008 Volume 15 Issue 4, Pages 820 - 833
- ^ Strategic Applications of Named Reactions in Organic Synthesis Laszlo Kurti, Barbara Czako Academic Press (March 4, 2005) ISBN 0-12-429785-4
- ^ Hassner, A., Stumer, C., Organic Synthesis Based on Name Reactions: 2nd. Ed. Tetrahedron Organic Chemistry Series, Volume 22 Pergamon, Oxford ISBN 0-08-043260-3
- ^ H. E. Ungnade, E. F. Orwoll. 3-Bromo-4-hydroxytoluene. Org. Synth. 1943, 23: 11. doi:10.15227/orgsyn.023.0011.
- ^ Kazem-Rostami, Masoud. Facile Preparation of Phenol. Synlett. 2017, 28 (13): 1641–1645. S2CID 99294625. doi:10.1055/s-0036-1588180.
- ^ Carey, F. A.; Sundberg, R. J. Advanced Organic Chemistry
 . Vol. B, Chapter 11: Springer. 2007: 1028.
. Vol. B, Chapter 11: Springer. 2007: 1028.
- ^ Khazaei, Ardeshir; Kazem-Rostami, Masoud; Zare, Abdolkarim; Moosavi-Zare, Ahmad Reza; Sadeghpour, Mahdieh; Afkhami, Abbas. Synthesis, characterization, and application of a triazene-based polysulfone as a dye adsorbent. Journal of Applied Polymer Science. 2013, 129 (6): 3439–3446. doi:10.1002/app.39069.
- ^ R. H. F. Manske. m-Nitrophenol. Org. Synth. 1928, 8: 80. doi:10.15227/orgsyn.008.0080.
- ^ Reinhard Bruckner, ed. Michael Harmata; Organic Mechanisms Reactions, Stereochemistry and Synthesis 3rd Ed, p.246, ISBN 978-3-8274-1579-0
- ^ DeTarr, D.F.; Kosuge, T. Mechanisms of Diazonium Salt Reactions. VI. The Reactions of Diazonium Salts with Alcohols under Acidic Conditions; Evidence for Hydride Transfer1. Journal of the American Chemical Society. 1958, 80 (22): 6072–6077. doi:10.1021/ja01555a044.
- ^ 邢其
毅 ; 裴偉偉 ;徐 瑞 秋 ; 裴堅. 18.基礎 有機 化學 978-7-301-27943-4第 四 版 .北京 :北京 大學 出版 社 . : 870. - ^ 邢其
毅 ; 裴偉偉 ;徐 瑞 秋 ; 裴堅. 18.基礎 有機 化學 978-7-301-27943-4第 四 版 .北京 :北京 大學 出版 社 . : 871. - ^ UK CRHF Incident Report – Supersaturated Diazonium salt causes Fatality. UK Chemical Reaction Hazards Forum. [13 May 2010]. (
原始 内容 存 档于6 October 2018).
外部 链接[编辑]
- 胺类
的 反 应(英文 )
