亚硝酸
| 亚 | |
|---|---|
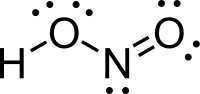
| |
| IUPAC Nitrous acid | |
Hydroxidooxidonitrogen 羟基氧化氮 | |
| 识别 | |
| CAS |
7782-77-6 |
| PubChem | 24529 |
| ChemSpider | 22936 |
| SMILES |
|
| Gmelin | 983 |
| 3DMet | B00022 |
| EINECS | 231-963-7 |
| ChEBI | 25567 |
| KEGG | C00088 |
| MeSH | Nitrous+acid |
| HNO2 | |
| 47.013 g·mol⁻¹ | |
| 约1g/ml | |
| pKa | 3.15 |
| 危险 | |
| NFPA 704 | |
| 闪点 | |
| 其他阴离 |
|
| 其他阳离 |
亚 亚 亚 |
亚
2,仅在
结构[编辑]
-
反 式 结构的 尺寸 -
顺式结构
制 备[编辑]
亚
- NaNO2 + H+ = HNO2 + Na+
反 应[编辑]
- 2 HNO2 = NO2 + NO + H2O
- 2 NO2 + H2O = HNO3 + HNO2
- 3 HNO2 = HNO3 + 2 NO + H2O
有 机 化学 [编辑]
亚
- HNO2+ RNH2 + H+ = RN+
2 + 2 H2O
其中R
这种盐广泛用于有
- 2 NaN3 + 2 HNO2 = 3 N2 + 2 NO + 2 NaOH
亚
- (CH3)2CHCH2CH2OH + HNO2 = (CH3)2CHCH2CH2ONO + H2O
- HNO2 + R2NH = R2N-NO + H2O
地球 大 气[编辑]
亚
参 见[编辑]
参考 资料[编辑]
- ^ 1.0 1.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. p. 462.
- ^ Y. Petit, M. Larchevêque. Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate. Org. Synth. 1998, 75: 37. doi:10.15227/orgsyn.075.0037.
- ^ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser. Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2'-bipyridine. Org. Synth. 2002, 78: 51. doi:10.15227/orgsyn.078.0051.
- ^ Kameoka, Yohji; Pigford, Robert. Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous. Ind. Eng. Chem. Fundamen. February 1977, 16 (1): 163–169. doi:10.1021/i160061a031.
- ^ Clarke, H. T.; Kirner, W. R. "Methyl Red" Organic Syntheses, Collected Volume 1, p.374 (1941). Archived copy (PDF). [2007-07-26]. (
原始 内容 (PDF)存 档于2007-09-30). - ^ Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995 [2022-09-29]. ISBN 978-0-309-05229-0. doi:10.17226/4911. (
原始 内容 存 档于2015-03-25). - ^ Spataro, F; Ianniello, A. Sources of atmospheric nitrous acid: state of the science, current research needs, and future prospects. Journal of the Air & Waste Management Association. November 2014, 64 (11): 1232–1250. PMID 25509545. doi:10.1080/10962247.2014.952846
 .
.
- ^ Anglada, Josef M.; Solé, Albert. The Atmospheric Oxidation of HONO by OH, Cl, and ClO Radicals. The Journal of Physical Chemistry A. November 2017, 121 (51): 9698–9707. Bibcode:2017JPCA..121.9698A. PMID 29182863. doi:10.1021/acs.jpca.7b10715.
| |||||||||||||||||||||||||||||||||||||
|




