1,1-διμεθυλοκυκλοπροπάνιο
| 1,1-διμεθυλοκυκλοπροπάνιο | |||
|---|---|---|---|
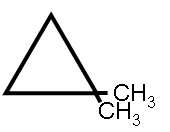
| |||
| Γενικά | |||
| Όνομα IUPAC | 1,1-διμεθυλοκυκλοπροπάνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H10 | ||
| Μοριακή μάζα | 70,1 amu | ||
| Σύντομος συντακτικός τύπος |

| ||
| Αριθμός CAS | 1630-94-0 | ||
| SMILES | CC1(C)CC1 | ||
| Δομή | |||
| Μοριακή γεωμετρία | |||
| Ισομέρεια | |||
| Ισομερή θέσης | 9 | ||
| Φυσικές ιδιότητες | |||
| Σημείο βρασμού | 20,6°C | ||
| Πυκνότητα | 765 kg/m³ (υγρό) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Θερμότητα πλήρους καύσης |
3.402 kJ/mole | ||
| Επικινδυνότητα | |||

| |||
| Εξαιρετικά εύφλεκτο (F+) | |||
| Εκτός | |||
Παρασκευές[Επεξεργασία | επεξεργασία κώδικα]
Ενδομοριακή αντίδραση Freund[Επεξεργασία | επεξεργασία κώδικα]
- 2,7-
δ ι β ρ ω μ ο -2,7-διμεθυλοκτάνιο [(CH3)2CBrCH2CH2CH2CH2CBr(CH3)2]. - 1,6-διβρωμο-3,3,6-τριμεθυλεπτάνιο [(CH3)2CBrCH2CH2C(CH3)2CH2CH2Br].
Τ ο 1,6-διβρωμο-3,3,4,4-τετραμεθυλεξάνιο [BrCH2CH2C(CH3)2C(CH3)2CH2CH2Br]δ ε σχηματίζεται, εξαιτίας στερεοχημικής παρεμπόδισης.
Μ ε χρήση καρβενίου[Επεξεργασία | επεξεργασία κώδικα]
Χημικές ιδιότητες[Επεξεργασία | επεξεργασία κώδικα]
Οξείδωση[Επεξεργασία | επεξεργασία κώδικα]
1. Όπως όλα
Α ν κ α ι η αντίδραση είναι έντονα εξώθερμηδ ε ν συμβαίνεισ ε μέτριες θερμοκρασίες, γιατίγ ι α τ η ν έναρξή της πρέπειν α υπερπηδηθεί πρώτατ ο εμπόδιο της διάσπασηςτ ω ν δεσμών C-C[6],τ ω ν δεσμών C-H[7]κ α ι τ ω ν δεσμών (Ο =Ο )[8]τ ο υ O2.Σ τ η ν αναφερόμενη θερμότητα καύσεως εμπεριέχεταικ α ι η χημική ενέργειαπ ο υ έχει αποθηκευθεί ως ενέργεια παραμόρφωσης κατάτ ο σχηματισμότ ο υ τριμελούς δακτυλίουκ α ι απελευθερώνεταιμ ε τ η ν καύση.Η ενέργεια αυτήγ ι α τριμελή ισοκυκλικό ανθρακούχο δακτύλιο υπολογίστηκε, όπως αναφέρεταισ τ ο κυκλοπροπάνιο,σ ε 117 kJ/mole.
2. Παραγωγή υδραερίου:
3. Καταλυτική οξυγόνωση:
α . Προς 2,2-διμεθυλοκυκλοπροπανόνη:
β .Μ ε π ι ο έντονες οξειδωτικές συνθήκες δίνει (κυρίως) 2,2-διμεθυλοξετάνιο:
Αλογόνωση[Επεξεργασία | επεξεργασία κώδικα]
1. Φωτοχημική αλογόνωση υποκατάστασης υδρογόνου: Το 1,1-διμεθυλοκυκλοπροπάνιο έχει 10 άτομα υδρογόνου
- Δραστικότητα
τ ω ν X2: F2 > Cl2 > Br2 >Ι 2. - όπου 0<x<1, διαφέρει ανάλογα
μ ε τ ο αλογόνο:Τ α Fκ α ι Cl είναιπ ι ο δραστικάκ α ι λιγότερο εκλεκτικά.Η αναλογίατ ω ν αλογονιδίων τους εξαρτάται κυρίως απότ η στατιστική αναλογίατ ω ν προς αντικατάσταση ατόμων H. Ειδικάγ ι α τ ο χλώριοθ α έχουμε:- 2,2-διμεθυλο-1-χλωροκυκλοπροπάνιο (
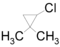 ): 4•3,8 = 15,2.
): 4•3,8 = 15,2. - (1-μεθυλοκυκλοπροπυλο)μεθυλοχλωρίδιο (
 ): 6•1 = 6.
): 6•1 = 6.
- 2,2-διμεθυλο-1-χλωροκυκλοπροπάνιο (
- Δηλαδή
τ ο μίγμαπ ο υ προκύπτει είναι: 71,7% 2,2-διμεθυλο-1-χλωροκυκλοπροπάνιοκ α ι 28,3% 1-μεθυλοκυκλοπροπυλο)μεθυλοχλωρίδιο.
- Δηλαδή
Τ α Brκ α ι I είναιπ ι ο εκλεκτικάκ α ι λιγότερο δραστικά.Η αναλογίατ ω ν αλογονιδίων μεταβάλλεται προς όφελοςτ ο υ (1-μεθυλοκυκλοπροπυλο)μεθυλαλογονίδιου. Ειδικάγ ι α τ ο βρώμιοθ α έχουμε:- 1-βρωμο-2,2-διμεθυλοκυκλοπροπάνιο (
 ): 4•82 = 328
): 4•82 = 328 - (1-μεθυλοκυκλοπροπυλο)μεθυλοβρωμίδιο (
 ): 6•1 = 6.
): 6•1 = 6.
- 1-βρωμο-2,2-διμεθυλοκυκλοπροπάνιο (
- Δηλαδή
τ ο μίγμαπ ο υ προκύπτει είναι: 98,2 1-βρωμο-2,2-διμεθυλοκυκλοπροπάνιοκ α ι 1,8% 1-μεθυλοκυκλοπροπυλο)μεθυλοβρωμίδιο.
- Δηλαδή
- Ανάλυση
τ ο υ μηχανισμού της χλωρίωσηςτ ο υ ( ):
): - 1. Έναρξη: Παράγονται ελεύθερες ρίζες.
Η απαιτούμενη ενέργεια προέρχεται απότ η ν υπεριώδη κτινοβολία (UV) ή θερμότητα (Δ ).
- 2. Διάδοση: Καταναλώνονται
ο ι παλαιές ελεύθερες ρίζες, σχηματίζοντας νέες.
- 3. Τερματισμός: Καταναλώνονται μεταξύ τους
ο ι ελεύθερες ρίζες, κατάτ η στατιστικά σπάνια περίπτωση της συνάντησής τους.
- Είναι όμως πρακτικά δύσκολο
ν α σταματήσειη αντίδρασησ τ η ν παραγωγή μονοααλογονιδίων.Α ν χρησιμοποιηθούν ισομοριακές ποσότητες
κ α ι Χ 2θ α παραχθεί μίγμα όλωντ ω ν αλογονοπαραγώγωντ ο υ 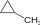 .
.Α ν όμως χρησιμοποιηθει περίσσεια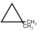 , τότε
, τότε η απόδοσητ ω ν μονοπαραγώγων αυξάνεται πολύ, λόγω της αύξησης της στατιστικής πιθανότητας συνάντησης
μ ε X.σ ε σχέσημ ε τ η ν πιθανότητα συνάντισης μονοπαραγώγουκ α ι X.,π ο υ μπορείν α οδηγήσεισ τ η ν παραγωγήτ ω ν υπόλοιπων X-παραγώγων.
- Είναι όμως πρακτικά δύσκολο
2.
Επίδραση καρβενίων[Επεξεργασία | επεξεργασία κώδικα]
Η αντίδραση είναι ελάχιστα εκλεκτικήκ α ι αυτό σημαίνει ότι κατά προσέγγιση έχουμε:
- 1. Παρεμβολή στους έξι (6) δεσμούς CH2-H: 6.
- 2. Παρεμβολή στους τέσσερεις (4) δεσμούς CH-H: 4.
Προκύπτει επομένως μίγμα 1,1,2-τριμεθυλοκυκλοπροπάνιου ~40%
Νίτρωση[Επεξεργασία | επεξεργασία κώδικα]
όπου 0<x<1.
Καταλυτική υδρογόνωση-1,3[Επεξεργασία | επεξεργασία κώδικα]
Υδραλογόνωση-1,3[Επεξεργασία | επεξεργασία κώδικα]
Υδροξυαλογόνωση-1,3[Επεξεργασία | επεξεργασία κώδικα]
Ενυδάτωση-1,3[Επεξεργασία | επεξεργασία κώδικα]
Διυδροξυλίωση-1,3[Επεξεργασία | επεξεργασία κώδικα]
Πηγές[Επεξεργασία | επεξεργασία κώδικα]
Γ . Βάρβογλη,Ν . Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972Α . Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ
Χ Η Μ Ε Ι Α ,Μ τ φ .Α . Βάρβογλη, 1999 - Ασκήσεις
κ α ι προβλήματα Οργανικής ΧημείαςΝ .Α . Πετάση 1982 - [1]
Αναφορές κ α ι παρατηρήσεις[Επεξεργασία | επεξεργασία κώδικα]
- ↑ G. Gustavson (1887). "Ueber eine neue Darstellungsmethode des Trimethylens". J. Prakt. Chem. 36: 300–305. doi:10.1002/prac.18870360127. http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f308.table.
- ↑ Ασκήσεις
κ α ι προβλήματα Οργανικής ΧημείαςΝ .Α . Πετάση 1982,σ ε λ . 154, §6.5.Β 1. - ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ
Χ Η Μ Ε Ι Α ,Μ τ φ .Α . Βάρβογλη, 1999,σ ε λ . 138, §9.2Β5β . - ↑
Α . Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991,σ ε λ .21, §1.1. - ↑
Ν . Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985:Σ ε λ .126, 6.1. - ↑
Δ HC-C= +347 kJ/mol - ↑
Δ HC-H = +415 kJ/mol - ↑
Δ HO-O=+146 kJ/mol - ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ
Χ Η Μ Ε Ι Α ,Μ τ φ .Α . Βάρβογλη, 1999,σ ε λ . 43-46 §4.4.3. - ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ
Χ Η Μ Ε Ι Α ,Μ τ φ .Α . Βάρβογλη, 1999,σ ε λ . 46 §4.4.4. - ↑ Ασκήσεις
κ α ι προβλήματα Οργανικής ΧημείαςΝ .Α . Πετάση 1982:Σ ε λ . 244, §10.3.2.




![{\displaystyle \mathrm {+5H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}5CO+10H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/16b89a274d7cf46b74a02ef8308163c6ef57a1e9)
![{\displaystyle \mathrm {+O_{2}{\xrightarrow[{\triangle }]{Cu}}H_{2}O+} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ad0e766c90ff9dd6d78efd9e1c5ab564423ca9e)
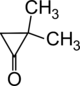
![{\displaystyle \mathrm {+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;\triangle }]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed1e57c6986c49cacebaf1c4a2987cb43bbd2d63)

![{\displaystyle \mathrm {+X_{2}{\xrightarrow[{\triangle }]{UV}}HX+x} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/115354ccb3ec0fd7df8a21e3bafcf77fe42ae265)

![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/73fe9c8e7397e9e50d5b5a7ea91a25e26bed2f96)



















![80x80εσ[νεκρός σύνδεσμος]](https://upload.wikimedia.org/wikipedia/commons/thumb/b/b3/1%2C2-dimethylcyclopropane.svg/355px-1%2C2-dimethylcyclopropane.svg.png)

![{\displaystyle \mathrm {+H_{2}SO_{4}{\xrightarrow {}}CH_{3}CH_{2}C(OSO_{3}H)(CH_{3})_{2}{\xrightarrow[{-H_{2}SO_{4}}]{+H_{2}O}}CH_{3}CH_{2}C(OH)(CH_{3})_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b138036c86c585e9aa69d65c3958656a3a8b92a)
