ヒトの細胞 さいぼう 核 かく 全体 ぜんたい 図 ず 核 かく 膜 まく 内 うち 膜 まく 外 そと 膜 まく 核 かく 膜 まく 孔 あな 接続 せつぞく 核 かく 膜 まく 英 えい nuclear membrane, nuclear envelope )は、真 ま 核 かく 生物 せいぶつ 核 かく 細胞 さいぼう 質 しつ 隔 へだ 生体 せいたい 膜 まく 遺伝 いでん 物質 ぶっしつ 内包 ないほう 内 うち 膜 まく 外 そと 膜 まく 二 に 重 じゅう 脂質 ししつ 二 に 重層 じゅうそう 構造 こうぞう 外 そと 膜 まく 小 しょう [ 1] 内 うち 膜 まく 外 そと 膜 まく 空間 くうかん 核 かく 膜 まく 槽 そう 呼 よ 幅 はば 約 やく [ 2] [ 3] 核 かく 膜 まく 存在 そんざい 核 かく 膜 まく 孔 あな 多数 たすう タンパク質 たんぱくしつ 核 かく 膜 まく 孔 あな 複 ふく 合体 がったい 構成 こうせい 核 かく 内外 ないがい 移動 いどう 物質 ぶっしつ 通 とお 道 みち [ 1] 内 うち 膜 まく 内側 うちがわ 核質 かくしつ 側 がわ ラミン からなる中間 ちゅうかん 径 みち 格子 こうし 状 じょう 裏打 うらう 構造 こうぞう 核 かく 形成 けいせい 核 かく 形態 けいたい 保 たも 中間 なかま 径 みち 外 そと 膜 まく 外側 そとがわ 緩 ゆる 構造 こうぞう 形成 けいせい 核 かく 膜 まく 構造 こうぞう 的 てき 支持 しじ 行 おこな [ 1]
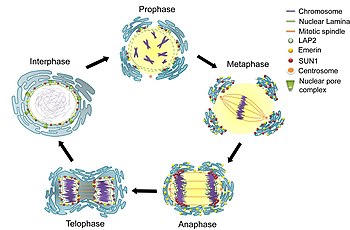
核 かく 膜 まく 細胞 さいぼう 分裂 ぶんれつ 際 さい 一時 いちじ 消失 しょうしつ 終期 しゅうき 再 さい 形成 けいせい
核 かく 膜 まく 内 うち 膜 まく 外 そと 膜 まく 二 に 重 じゅう 脂質 ししつ 二 に 重層 じゅうそう 構造 こうぞう 内 うち 膜 まく 外 そと 膜 まく 核 かく 膜 まく 孔 あな 互 たが 連結 れんけつ 種類 しゅるい 中間 ちゅうかん 径 みち 核 かく 膜 まく 支持 しじ 行 おこな 内側 うちがわ 内 うち 膜 まく 内側 うちがわ 形成 けいせい 核 かく [ 4] 外 そと 膜 まく 外側 そとがわ 緩 ゆる 形成 けいせい 外側 そとがわ 支持 しじ 行 おこな [ 1]
外 そと 膜 まく 小 しょう 膜 まく 連続 れんぞく [ 5] 外 そと 膜 まく 小 しょう 膜 まく 物理 ぶつり 的 てき 連結 れんけつ 一方 いっぽう 小 しょう 膜 まく 高 こう 濃度 のうど タンパク質 たんぱくしつ 含 ふく [ 6] 哺乳類 ほにゅうるい 存在 そんざい ネスプリン (英語 えいご 版 ばん タンパク質 たんぱくしつ 外 がい 膜 まく 発現 はつげん [ 7] タンパク質 たんぱくしつ KASHドメイン (英語 えいご 版 ばん 持 も LINC複 ふく 合体 がったい (英語 えいご 版 ばん 一部 いちぶ 細胞 さいぼう 骨格 こっかく 繊維 せんい 核 かく 骨格 こっかく 連結 れんけつ [ 8] [ 9] [ 10] 介 かい 細胞 さいぼう 骨格 こっかく 連結 れんけつ 核 かく 配置 はいち 細胞 さいぼう 機械 きかい 受容 じゅよう 機能 きのう 寄与 きよ [ 11] アクチン 繊維 せんい 細胞 さいぼう 骨格 こっかく 構成 こうせい 要素 ようそ 直接 ちょくせつ 結合 けつごう 核 かく 膜 まく 槽 そう タンパク質 たんぱくしつ 結合 けつごう [ 9] [ 10] 核 かく 輸送 ゆそう 積 つ 荷 に 降 お 過程 かてい 寄与 きよ 可能 かのう 性 せい プレクチン (plectin) に結合 けつごう 核 かく 膜 まく 細胞 さいぼう 質 しつ 中 なか 間 あいだ 径 みち 連結 れんけつ [ 12] 微小 びしょう 管 かん 端 はし 方向 ほうこう 移動 いどう モータータンパク質 たんぱくしつ のキネシン-1 と結合 けつごう [ 13] 外 そと 膜 まく 内 うち 膜 まく 融合 ゆうごう 核 かく 膜 まく 孔 あな 形成 けいせい 過程 かてい 細胞 さいぼう 成長 せいちょう 寄与 きよ [ 14]
内 うち 膜 まく 核質 かくしつ 包 つつ 内 うち 膜 まく 内側 うちがわ 核 かく 呼 よ 状 じょう 中 なか 間 あいだ 径 みち 覆 おお 核 かく 厚 あつ 約 やく 核 かく 膜 まく 安定 あんてい 化 か クロマチン の機能 きのう 遺伝子 いでんし 発現 はつげん 関与 かんよ [ 6] 内 うち 膜 まく 核 かく 膜 まく 貫 つらぬ 核 かく 膜 まく 孔 あな 外 そと 膜 まく 連結 れんけつ 内 うち 膜 まく 外 そと 膜 まく 小 しょう 膜 まく 連結 れんけつ 膜 まく 埋 う 込 こ タンパク質 たんぱくしつ 連続 れんぞく 体 たい 中 ちゅう 拡散 かくさん 場 ば 留 と 傾向 けいこう [ 15]
内 うち 膜 まく タンパク質 たんぱくしつ 変異 へんい ラミノパシー と呼 よ 疾患 しっかん 引 ひ 起 お
核 かく 膜 まく 横切 よこぎ 核 かく 膜 まく 孔 あな 核 かく 膜 まく 核 かく 膜 まく 孔 あな 穴 あな 数 すう 千 せん 個 こ 程度 ていど 存在 そんざい 核 かく 膜 まく 孔 あな 直径 ちょっけい 約 やく タンパク質 たんぱくしつ 複 ふく 合体 がったい 内側 うちがわ 直径 ちょっけい 約 やく [ 6] 核 かく 膜 まく 孔 あな 内 うち 膜 まく 外 そと 膜 まく 連結 れんけつ
細胞 さいぼう 周期 しゅうき 間 あいだ 期 き G2期 き の間 あいだ 核 かく 膜 まく 表面積 ひょうめんせき 増 ま 核 かく 膜 まく 孔 あな 数 かず 倍増 ばいぞう [ 6] 酵母 こうぼ 真 ま 核 かく 生物 せいぶつ 形式 けいしき 有 ゆう 糸 いと 分裂 ぶんれつ 行 おこな 核 かく 膜 まく 細胞 さいぼう 分裂 ぶんれつ 中 なか 形成 けいせい 紡錘 ぼうすい 糸 いと 核 かく 膜 まく 内部 ないぶ 形成 けいせい 核 かく 膜 まく 貫通 かんつう [ 6] 他 た 真 ま 核 かく 生物 せいぶつ 動物 どうぶつ 植物 しょくぶつ 形式 けいしき 有 ゆう 糸 いと 分裂 ぶんれつ 行 おこな 紡錘 ぼうすい 糸 いと 内部 ないぶ 染色 せんしょく 体 たい 核 かく 膜 まく 前 ぜん 中期 ちゅうき 間 あいだ 解体 かいたい 核 かく 膜 まく 解体 かいたい 再 さい 形成 けいせい 過程 かてい 解明 かいめい
有 ゆう 糸 いと 分裂 ぶんれつ 解体 かいたい 再 さい 形成 けいせい 哺乳類 ほにゅうるい 有 ゆう 糸 いと 分裂 ぶんれつ 初期 しょき 一連 いちれん 段階 だんかい 後 のち 核 かく 膜 まく 数 すう 分 ふん 以内 いない 解体 かいたい M-Cdk がヌクレオポリン のポリペプチドをリン酸化 さんか し、それらは核 かく 膜 まく 孔 あな 複 ふく 合体 がったい 選択 せんたく 的 てき 除去 じょきょ 後 ご 核 かく 膜 まく 孔 あな 複 ふく 合体 がったい 残 のこ 部分 ぶぶん 同時 どうじ 解体 かいたい 核 かく 膜 まく 孔 あな 複 ふく 合体 がったい 小 ちい 断片 だんぺん 分解 ぶんかい 安定 あんてい 解体 かいたい 生化学 せいかがく 的 てき 証拠 しょうこ 示唆 しさ [ 6] 核 かく 要素 ようそ 酸化 さんか 解体 かいたい 核 かく 膜 まく 小 ちい 小 しょう 解体 かいたい [ 16] 核 かく 膜 まく 小 しょう 吸収 きゅうしゅう 強力 きょうりょく 証拠 しょうこ 電子 でんし 顕微鏡 けんびきょう 蛍光 けいこう 顕微鏡 けんびきょう 得 え 通常 つうじょう 小 しょう 見 み 核 かく 内 ない タンパク質 たんぱくしつ 有 ゆう 糸 いと 分裂 ぶんれつ 中 ちゅう 出現 しゅつげん [ 6]
哺乳類 ほにゅうるい 細胞 さいぼう 有 ゆう 糸 いと 分裂 ぶんれつ 前 ぜん 中期 ちゅうき 核 かく 膜 まく 解体 かいたい 以外 いがい 細胞 さいぼう 移動 いどう 核 かく 膜 まく 破 わ [ 17] 一時 いちじ 的 てき 破壊 はかい 細胞 さいぼう 質 しつ タンパク質 たんぱくしつ 複 ふく 合体 がったい ESCRT (endosomal sorting complexes required for transport) によって迅速 じんそく 修復 しゅうふく [ 17] 核 かく 膜 まく 破 やぶ 間 あいだ 本 ほん 鎖 くさり 切断 せつだん 引 ひ 起 お 限 かぎ 環境 かんきょう 通 とお 移動 いどう 細胞 さいぼう 生存 せいぞん 効率 こうりつ 的 てき 核 かく 膜 まく 修復 しゅうふく 装置 そうち 依存 いぞん 考 かんが
核 かく 膜 まく 解体 かいたい 異常 いじょう 細胞 さいぼう 観察 かんさつ 細胞 さいぼう タンパク質 たんぱくしつ 誤 あやま 局在 きょくざい 小 しょう 核 かく 形成 けいせい 不安定 ふあんてい 性 せい [ 18] [ 19] [ 20]
終期 しゅうき 核 かく 膜 まく 再 さい 形成 けいせい 正確 せいかく 機構 きこう 議論 ぎろん 理論 りろん 存在 そんざい [ 6]
小 しょう 融合 ゆうごう 核 かく 膜 まく 小 しょう 互 たが 融合 ゆうごう 核 かく 膜 まく 再 さい 構築 こうちく 小 しょう 整形 せいけい 小 しょう 吸収 きゅうしゅう 核 かく 膜 まく 含 ふく 部分 ぶぶん 核 かく 空間 くうかん 包 つつ 閉 と 膜 まく 再 さい 形成 けいせい 比較 ひかく 進化 しんか 核 かく 膜 まく 起源 きげん 研究 けんきゅう 核 かく 原始 げんし 的 てき 真 ま 核 かく 生物 せいぶつ 祖先 そせん 出現 しゅつげん 古 こ 細菌 さいきん 細菌 さいきん 共生 きょうせい 引 ひ 起 お 提唱 ていしょう [ 21] 核 かく 膜 まく 進化 しんか 的 てき 起源 きげん 考 かんが 提唱 ていしょう 原核 げんかく 生物 せいぶつ 祖先 そせん 細胞 さいぼう 膜 まく 陥 おちい 入 いれ 古 こ 細菌 さいきん 宿主 しゅくしゅ 中 ちゅう 始原 しげん 的 てき ミトコンドリア の存在 そんざい 確立 かくりつ 伴 ともな 新規 しんき 膜 まく 系 けい 形成 けいせい 唱 とな [ 22] 核 かく 膜 まく 適応 てきおう 的 てき 機能 きのう 祖先 そせん 細胞 さいぼう 中 ちゅう 産 さん 生 む 活性 かっせい 酸素 さんそ 種 しゅ ゲノム を保護 ほご 障壁 しょうへき 可能 かのう 性 せい [ 23] [ 24]
^ a b c d Alberts, Bruce (2002). Molecular biology of the cell (4th ed.). New York [u.a.]: Garland. p. 197. ISBN 0815340729
^ “Perinuclear space ”. Dictionary . Biology Online. 7 December 2012 閲覧 えつらん ^ Berrios, Miguel, ed. (1998). Nuclear structure and function. . San Diego: Academic Press. p. 4. ISBN 9780125641555 ^ “Molecular ageing in progeroid syndromes: Hutchinson-Gilford progeria syndrome as a model ”. Immunity & Ageing : I & A . pp. 4 (20 April 2009). doi :10.1186/1742-4933-6-4 . 11 March 2018 閲覧 えつらん ^ “Chloride channels in the Nuclear membrane ”. Harvard.edu. 7 December 2012 閲覧 えつらん ^ a b c d e f g h Hetzer, Mertin (February 3, 2010). “The Nuclear Envelope” . Cold Spring Harbor Perspectives in Biology 2 (3): a000539. doi :10.1101/cshperspect.a000539 . PMC 2829960 . PMID 20300205 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2829960/ .
^ Wilson, Katherine L.; Berk, Jason M. (2010-06-15). “The nuclear envelope at a glance” (英語 えいご J Cell Sci 123 (12): 1973–1978. doi :10.1242/jcs.019042 . ISSN 0021-9533 . PMC 2880010 . PMID 20519579 . http://jcs.biologists.org/content/123/12/1973 . ^ Burke, Brian; Roux, Kyle J. (2009-11-01). “Nuclei take a position: managing nuclear location”. Developmental Cell 17 (5): 587–597. doi :10.1016/j.devcel.2009.10.018 . ISSN 1878-1551 . PMID 19922864 . ^ a b Crisp, Melissa; Liu, Qian; Roux, Kyle; Rattner, J. B.; Shanahan, Catherine; Burke, Brian; Stahl, Phillip D.; Hodzic, Didier (2006-01-02). “Coupling of the nucleus and cytoplasm: role of the LINC complex” . The Journal of Cell Biology 172 (1): 41–53. doi :10.1083/jcb.200509124 . ISSN 0021-9525 . PMC 2063530 . PMID 16380439 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2063530/ .
^ a b Zeng et. al, X (2017). “Nuclear Envelope-Associated Chromosome Dynamics during Meiotic Prophase I.”. Frontiers in Cell and Developmental Biology 5 : 121. doi :10.3389/fcell.2017.00121 . PMID 29376050 .
^ Uzer, Gunes; Thompson, William R.; Sen, Buer; Xie, Zhihui; Yen, Sherwin S.; Miller, Sean; Bas, Guniz; Styner, Maya et al. (2015-06-01). “Cell Mechanosensitivity to Extremely Low-Magnitude Signals Is Enabled by a LINCed Nucleus” (英語 えいご Stem Cells 33 (6): 2063–2076. doi :10.1002/stem.2004 . ISSN 1066-5099 . PMC 4458857 . PMID 25787126 . http://europepmc.org/articles/pmc4458857 . ^ Wilhelmsen, Kevin; Litjens, Sandy H. M.; Kuikman, Ingrid; Tshimbalanga, Ntambua; Janssen, Hans; van den Bout, Iman; Raymond, Karine; Sonnenberg, Arnoud (2005-12-05). “Nesprin-3, a novel outer nuclear membrane protein, associates with the cytoskeletal linker protein plectin” . The Journal of Cell Biology 171 (5): 799–810. doi :10.1083/jcb.200506083 . ISSN 0021-9525 . PMC 2171291 . PMID 16330710 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2171291/ . ^ Roux, Kyle J.; Crisp, Melissa L.; Liu, Qian; Kim, Daein; Kozlov, Serguei; Stewart, Colin L.; Burke, Brian (2009-02-17). “Nesprin 4 is an outer nuclear membrane protein that can induce kinesin-mediated cell polarization” . Proceedings of the National Academy of Sciences of the United States of America 106 (7): 2194–2199. doi :10.1073/pnas.0808602106 . ISSN 1091-6490 . PMC 2650131 . PMID 19164528 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2650131/ . ^ Fichtman, Boris; Ramos, Corinne; Rasala, Beth; Harel, Amnon; Forbes, Douglass J. (2010-12-01). “Inner/Outer Nuclear Membrane Fusion in Nuclear Pore Assembly” . Molecular Biology of the Cell 21 (23): 4197–4211. doi :10.1091/mbc.E10-04-0309 . ISSN 1059-1524 . PMC 2993748 . PMID 20926687 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2993748/ . ^ “The inner nuclear membrane: simple, or very complex?” . The EMBO Journal 20 (12): 2989–2994. (April 19, 2001). doi :10.1093/emboj/20.12.2989 . PMC 150211 . PMID 11406575 . http://www.nature.com/emboj/journal/v20/n12/full/7593796a.html 7 December 2012 閲覧 えつらん ^ Alberts (et al) (2008). “Chapter 17: The Cell Cycle”. Molecular Biology of The Cell (5th ed.). New York: Garland Science. pp. 1079–1080. ISBN 978-0-8153-4106-2 ^ a b “ESCRT III repairs nuclear envelope ruptures during cell migration to limit DNA damage and cell death”. Science 352 (6283): 359–62. (2016). doi :10.1126/science.aad7611 . PMID 27013426 .
^ Vargas, Jesse D.; Hatch, Emily M.; Anderson, Daniel J.; Hetzer, Martin W. (2012-1). “Transient nuclear envelope rupturing during interphase in human cancer cells” . Nucleus (Austin, Tex.) 3 (1): 88–100. doi :10.4161/nucl.18954 . ISSN 1949-1042 . PMC 3342953 . PMID 22567193 . https://www.ncbi.nlm.nih.gov/pubmed/22567193 . ^ Lim, Sanghee; Quinton, Ryan J.; Ganem, Neil J. (11 01, 2016). “Nuclear envelope rupture drives genome instability in cancer” . Molecular Biology of the Cell 27 (21): 3210–3213. doi :10.1091/mbc.E16-02-0098 . ISSN 1939-4586 . PMC 5170854 . PMID 27799497 . https://www.ncbi.nlm.nih.gov/pubmed/27799497 . ^ Hatch, Emily M.; Hetzer, Martin W. (2016-10-10). “Nuclear envelope rupture is induced by actin-based nucleus confinement” . The Journal of Cell Biology 215 (1): 27–36. doi :10.1083/jcb.201603053 . ISSN 1540-8140 . PMC 5057282 . PMID 27697922 . https://www.ncbi.nlm.nih.gov/pubmed/27697922 . ^ “Comparative genomics, evolution and origins of the nuclear envelope and nuclear pore complex”. Cell Cycle 3 (12): 1612–37. (2004). doi :10.4161/cc.3.12.1316 . PMID 15611647 . ^ “Archaebacteria (Archaea) and the origin of the eukaryotic nucleus”. Curr. Opin. Microbiol. 8 (6): 630–7. (2005). doi :10.1016/j.mib.2005.10.004 . PMID 16242992 . ^ “Birth of the eukaryotes by a set of reactive innovations: New insights force us to relinquish gradual models”. BioEssays 37 (12): 1268–76. (2015). doi :10.1002/bies.201500107 . PMID 26577075 . ^ Bernstein H, Bernstein C. Sexual communication in archaea, the precursor to meiosis. pp. 103-117 in Biocommunication of Archaea (Guenther Witzany, ed.) 2017. Springer International Publishing ISBN 978-3-319-65535-2 DOI 10.1007/978-3-319-65536-9
ウィキメディア・コモンズには、
核 かく 膜 まく に
関連 かんれん するカテゴリがあります。