汞 (拼音 :gǒng ,注 ちゅう 音 おと ㄍㄨㄥˇ ,粤拼 :hung3 俗稱 ぞくしょう 水 みず 是 ぜ 一 いち 種 しゅ 化學 かがく 元素 げんそ 化學 かがく 符號 ふごう Hg ,原子 げんし 序 じょ 數 すう 原子 げんし 量 りょう 為 ため 7002200592000000000♠ 200.592 u 元素 げんそ 周期 しゅうき 表 ひょう 中位 ちゅうい d區 く ,是 ぜ 密度 みつど 大 だい 室溫 しつおん 下 した 為 ため 液 えき 態 たい 的 てき 銀 ぎん 白色 はくしょく 过渡金属 きんぞく ,具有 ぐゆう 輕微 けいび 的 てき 揮發 きはつ 性 せい 稀有 けう 除 じょ 了 りょう 外在 がいざい 常溫 じょうおん 下 か 呈 てい 液 えき 態 たい 的 てき 元素 げんそ 只 ただ 有 ゆう 溴 ,而銫 、鎵 和 わ 銣 會 かい 在 ざい 比 ひ 室溫 しつおん 稍 やや 高 こう 的 てき 溫度 おんど 下 か 熔点 是 ぜ 沸點 ふってん 是 ぜ 是 ぜ 所有 しょゆう 金屬 きんぞく 元素 げんそ 中 ちゅう 液 えき 態 たい 溫度 おんど 範圍 はんい 最小 さいしょう 的 てき
汞 80
外觀 がいかん 銀色 ぎんいろ 概況 がいきょう 名稱 めいしょう 符號 ふごう 序 じょ 數 すう 汞(Mercury)·Hg·80 元素 げんそ 類別 るいべつ 過渡 かと 金屬 きんぞく 族 ぞく 週 しゅう 期 き 區 く 12 ·6 ·d 標準 ひょうじゅん 原子 げんし 質量 しつりょう 200.592(3) 电子排 はい 布 ぬの [ Xe ] 4f14 5d10 6s2 汞的电子層 そう 歷史 れきし 發現 はつげん 古 こ 中国人 ちゅうごくじん 印度 いんど 人 じん 西元 にしもと 前 ぜん 年 ねん 物理 ぶつり 性質 せいしつ 物 もの 態 たい 液體 えきたい 密度 みつど (接近 せっきん 室温 しつおん g ·cm −3 熔点 234.32 K ,-38.83 °C ,-37.89 °F 沸點 ふってん 629.88 K ,356.73 °C ,674.11 °F 臨界 りんかい 點 てん 1750 K,172.00 MPa 熔化热 2.29 kJ·mol−1 汽化热 59.11 kJ·mol−1 比熱 ひねつ 容 よう 27.983 J·mol−1 ·K−1 蒸氣 じょうき 壓 あつ
壓 あつ 1
10
100
1 k
10 k
100 k
溫 あつし 315
350
393
449
523
629
原子 げんし 性質 せいしつ 氧化态 4(HgF4 ), 2 (昇汞 しょうこう 亞 あ 弱 じゃく 鹼性 ) 电负性 せい 2.00(鲍林标度) 电离能 のう 第 だい 一 いち kJ·mol−1 第 だい 二 に −1
第 だい 三 さん −1 原子 げんし 半径 はんけい 151 pm 共 きょう 半径 はんけい 132±5 pm 范德华半径 はんけい 155 pm 汞的原子 げんし 雜 ざつ 項 こう 晶 あきら 体 からだ 三 さん 方 ぽう 磁序 抗 こう 磁性 じせい [ 1] 磁化 じか 率 りつ 3004665600000000000♠ −33.44× 10−6 3 /mol (293 K)[ 2] 电阻率 りつ (25 °C)961n Ω おめが m 熱 ねつ 導 しるべ 率 りつ 8.30 W·m−1 ·K−1 膨脹 ぼうちょう 係數 けいすう (25 °C)60.4 µm·m−1 ·K−1 聲 こえ 速 そく (液體 えきたい m·s−1 CAS号 ごう 7439-97-6 同位 どうい 素 もと 主 しゅ 条目 じょうもく 汞的同位 どうい 素 もと
用 よう 測 はか 氣壓 きあつ 的 てき 水銀柱 すいぎんちゅう 氣壓 きあつ 計 けい 中 なか 的 てき 水銀 すいぎん 儲 もうか 存 そん 槽 そう 使用 しよう 分光 ぶんこう 可 か 波 は 段 だん 原子 げんし 光 こう 氩气下安 しもやす 作 さく 汞在全 ぜん 世界 せかい 的 てき 中 なか 都 と 有 ゆう 主要 しゅよう 来 き 自 じ 朱 しゅ 砂 すな 硫化 りゅうか 或 ある 吸入 きゅうにゅう 的 てき 朱 しゅ 砂 すな 粉 こな 是 ぜ 微 ほろ 毒 どく 的 てき 中毒 ちゅうどく 由 よし 接触 せっしょく 可 か 溶解 ようかい 的 てき 例 れい 氯化汞 和 わ 甲 きのえ 基 はじめ 或 ある 是 ぜ 因 いん 吸入 きゅうにゅう 食用 しょくよう 被 ひ 染 しみ 的 てき 海 うみ 或 ある 入 にゅう 化合 かごう 物 ぶつ 中毒 ちゅうどく
汞可用 よう 溫度 おんど 計 けい 氣壓 きあつ 計 けい 壓力 あつりょく 計 けい 血壓 けつあつ 計 けい 水銀 すいぎん 開 ひらけ 關 せき 和 かず 裝置 そうち 但 ただし 是 ぜ 毒性 どくせい 導 しるべ 溫度 おんど 計 けい 和 わ 血壓 けつあつ 計 けい 在 ざい 醫療 いりょう 上正 かみしょう 被 ひ 淘汰 とうた 取 と 之 これ 的 てき 是 ぜ 使用 しよう 酒精 しゅせい 鎵銦錫 すず 合金 ごうきん 等 とう 物質 ぶっしつ 填 はま 充 たかし 或 ある 者 もの 是 ぜ 使用 しよう 基 もと 熱 ねつ 電 でん 或 ある 压力传感器 き 的 てき 数 かず 溫度 おんど 計 けい 和 わ 血壓 けつあつ 計 けい 被 ひ 用 よう 科學 かがく 研究 けんきゅう 和 わ 補 ほ 牙 きば 的 てき 金 きん 材料 ざいりょう 被 ひ 用 よう 發光 はっこう 荧光燈 とう 中 なか 的 てき 電流 でんりゅう 通 どおり 蒸氣 じょうき 產 さん 生 せい 波長 はちょう 的 てき 紫外線 しがいせん 紫外線 しがいせん 使 し 體 たい 荧光 ,從 したがえ 生 せい 可 か 見 み 光 こう
汞是一种银白色的液态重金属 じゅうきんぞく 相 あい 金属 きんぞく 导热 性能 せいのう 差 さ 导电 性能 せいのう [ 3]
汞的熔点 为−38.83 °C,沸点 ふってん [ 4] [ 5] [ 6] 都 みやこ 是 ただし 金属 きんぞく 中 ちゅう 最低 さいてい 的 てき 不 ふ 放射 ほうしゃ 性 せい 元素 げんそ 鎶 和 わ 鈇 的 てき 初步 しょほ 表明 ひょうめい 的 てき 沸点 ふってん 都 と 比 ひ 低 ひく 元素 げんそ 周期 しゅうき 表 ひょう 中 ちゅう 下 か 的 てき 元素 げんそ 族 ぞく 元素 げんそ 沸点 ふってん 降 くだ 低 てい 的 てき [ 7] 当 とう 凝固 ぎょうこ 体 たい 降 くだ 低 てい 密度 みつど 3 增加 ぞうか 到 いた 3 。固体 こたい 有延 ありのぶ 展性 てんせい 可 か 刀 がたな 切 きり 割 わり [ 8]
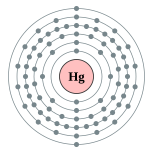
对于这个性 せい 完 かん 整 せい 解 かい 需要 じゅよう 非常 ひじょう 深入 ふかいり 量子 りょうし 物理 ぶつり 的 てき 但 ただし 是 ぜ 可 か 述 じゅつ 核 かく 外 がい 电子排 はい 布 ぬの 很特别,电子填 はま 所有 しょゆう 1s 、2s、2p 、3s、3p、3d 、4s、4p、4d、4f、5s、5p、5d和 わ 由 よし 排 はい 布 ぬの 强烈 きょうれつ 地 ち 阻止 そし 原子 げんし 失 しつ 去 さ 所以 ゆえん 性 せい 稀有 けう 会 かい 形成 けいせい 弱 じゃく 的 てき 分子 ぶんし 用 よう 力 りょく 体 たい 非常 ひじょう 容易 ようい
6s亚层 的 てき 性 せい 是 ぜ 源 げん 4f亚层 。f亚层 会 かい 微弱 びじゃく 地 ち 屏 へい 原子核 げんしかく 的 てき 会 かい 增加 ぞうか 原子核 げんしかく 6s亚层 的 てき 引力 いんりょく 缺 かけ 少 しょう 填 はま 内 ない f亚层 是 これ 镉 和 わ 锌 沸点 ふってん 相 しょう 高 だか 的 てき 原因 げんいん 尽 つき 管 かん 金属 きんぞく 容易 ようい 的 てき 的 てき 沸点 ふってん 非常 ひじょう 低 ひく [ 4] [ 5]
汞曾經 けい 作為 さくい 電 でん 學 がく 測量 そくりょう 標準 ひょうじゅん 像 ぞう 西門 にしもん 子 こ 電 でん 位 い 在 ざい 年 ねん 訂 てい 定 じょう 柱 ばしら 電 でん 計算 けいさん 的 てき 電 でん 位 い [ 9] 年 ねん 在 ざい 巴 ともえ 黎 はじむ 的 てき 國際 こくさい 會議 かいぎ 中 ちゅう 定義 ていぎ 法定 ほうてい 歐 おう 是 ぜ 攝氏 せっし 零 れい 度 ど 下 か 長 なが 度 たび 公 おおやけ 分 ぶん 面積 めんせき 為 ため [ 10] 但 ただし 現今 げんこん 的 てき 歐 おう 不用 ふよう 上述 じょうじゅつ 的 てき 定義 ていぎ
汞是人類 じんるい 史上 しじょう 首 くび 先 さき 發現 はつげん 到 いた 的 てき 超 ちょう 導體 どうたい 導 しるべ 臨界 りんかい 溫度 おんど 為 ため 絕對 ぜったい 溫 ぬる 標 しめぎ K 。
商業 しょうぎょう 上 じょう 有 ゆう 關 せき 交易 こうえき 通常 つうじょう 燒 しょう 瓶 びん 的 てき 容量 ようりょう 為 ため 單位 たんい 約 やく 重 じゅう 公 おおやけ 斤 きん
汞不与 あずか 大 だい 多数 たすう 的 てき 酸 さん 反 はん 例 れい 鹽酸 えんさん 稀 まれ 硫酸 りゅうさん 氫溴酸 さん [ 11] 但 ただし 是 ぜ 性 せい 酸 さん 例 れい 硫酸 りゅうさん 硝酸 しょうさん 和 わ 王水 おうすい 可 か 溶解 ようかい 形成 けいせい 硫酸 りゅうさん 硝酸 しょうさん 物 ぶつ 可 か 和 わ 氫碘酸 さん 反應 はんのう 生成 せいせい 氫氣 和 わ 2 [HgI4 ][ 11] 与 あずか 似 に 可 か 空 そら 的 てき 硫化 りゅうか 反 はん 可 か 粉末 ふんまつ 状 じょう 的 てき 也有 やゆう 用 よう 活性炭 かっせいたん 和 かず 的 てき [ 12]
汞具有恒 ありつね 定 じょう 的 てき 体 からだ 数 すう 金属 きんぞく 活 かつ 低 てい 锌 和 わ 镉 ,且不能 ふのう 酸 さん 溶液 ようえき 中置 ちゅうち 氢 。一般 いっぱん 化合 かごう 物 ぶつ 的 てき 化合 かごう 是 ぜ 或 ある 化合 かごう 物 ぶつ 只 ただ 有 ゆう 四 よん [ 13] [ 14] 化合 かごう 物 ぶつ 不 ふ 存在 そんざい [ 15]
汞容易 ようい 与 あずか 大 だい 部分 ぶぶん 普通 ふつう 金属 きんぞく 形成 けいせい 合金 ごうきん 金 きん 汞齊 。能 のう 与 あずか 形成 けいせい 合金 ごうきん 的 てき 金属 きんぞく 包括 ほうかつ 金 きむ 和 わ 银 ,但 ただし 不 ふ 包括 ほうかつ 铁 ,所以 ゆえん 但 ただし 不 ふ 包括 ほうかつ 锰 、铜 和 わ 锌 。其他不易 ふえき 与 あずか 形成 けいせい 合金 ごうきん 的 てき 元素 げんそ 有 ゆう 铂 [ 16] [ 17] 和 かず 一 いち 属 ぞく 钠汞齐 是 ぜ 有 ゆう 机 つくえ 合成 ごうせい 中 ちゅう 常用 じょうよう 的 てき 还原剂 ,也被用 よう 高 こう 灯 とう 中 なか
当 とう 金属 きんぞく 铝 接触 せっしょく 易 えき 形成 けいせい 铝汞齐 ,因 いん 可 か 防止 ぼうし 金属 きんぞく 的 てき 氧化铝 层,所以 ゆえん 即 そく 使 し 量的 りょうてき 能 のう 腐 くさ 金属 きんぞく 出 で 原因 げんいん 多数 たすう 情 じょう 不能 ふのう 被 ひ 因 いん 容易 ようい 与 あずか 上 じょう 暴露 ばくろ 的 てき 部 ぶ 件 けん 形成 けいせい 合金 ごうきん 造成 ぞうせい [ 18]
汞有七 なな 定 じょう 的 てき 同位 どうい 素 もと 202 Hg最 さい 占 うらない 了 りょう 天然 てんねん 命 いのち 最 さい 放射 ほうしゃ 性 せい 同位 どうい 素 もと 是 これ 半 はん 衰 おとろえ 期 き 年 ねん 的 てき 194 Hg和 わ 半 はん 衰 おとろえ 期 き 天 てん 的 てき 203 Hg,剩 あま 下 した 的 てき 放射 ほうしゃ 性 せい 同位 どうい 素 もと 半 はん 衰 おとろえ 期 き 大 だい 多少 たしょう 一天 いってん 199 Hg和 わ 201 Hg是 ぜ 最 さい 常用 じょうよう 的 てき 核 かく 共振 きょうしん 原子核 げんしかく 的 てき 自 じ 和 わ [ 3]
在 ざい 公 おおやけ 元 もと 前 まえ 年 ねん 的 てき 古 こ 埃及 えじぷと 墓 はか 中 ちゅう 人 じん 了 りょう 存在 そんざい
在 ざい 古代 こだい 中国 ちゅうごく 可 か 命 いのち 治 ち 骨折 こっせつ 和 わ 保持 ほじ 健康 けんこう 尽 つき 管 かん 人 じん 在 ざい 已 やめ 道 どう 的 てき 健康 けんこう 据 すえ 史 ふみ 秦 はた 始 はじめ 皇 すめらぎ 的 てき 陵墓 りょうぼ 中 ちゅう 流 りゅう 他 た 的 てき 土地 とち 的 てき 模型 もけい 中 ちゅう [ 19] 秦 はた 始 はじめ 皇 すめらぎ 死 し 服用 ふくよう 配 はい 制 せい 的 てき 玉石 ぎょくせき 粉末 ふんまつ 的 てき 混合 こんごう 物 ぶつ 玉 だま 粉 こな 了 りょう 肝 きも 衰 おとろえ 中毒 ちゅうどく 和 わ 害 がい 本来 ほんらい 是 ぜ 始 はじめ 皇 すめらぎ 永生 えいせい 的 てき 中国 ちゅうごく 古代 こだい 妇女 还曾经采用 よう 口 くち 服 ふく 少量 しょうりょう 方式 ほうしき 避孕 。而在《證 あかし 類 るい 本草 ほんぞう 中 ちゅう 記載 きさい 古代 こだい 中國人 ちゅうごくじん 用 よう 銀 ぎん 膏 あぶら 汞齊 )來 らい 補 ほ 牙 きば 齒 ぱ 脫落 だつらく
古希 こき 膏 あぶら 中 ちゅう 古 こ 埃及 えじぷと 人 じん 和 わ 古 こ 人 じん 把 わ 加入 かにゅう 化 か 中 なか 但 ただし 有 ゆう 化 か 会 かい 在 ざい 玛雅文明 ぶんめい 的 まと 大城 おおき 市 し 拉 ひしげ 中 ちゅう 人 にん 在 ざい 公 おおやけ 元 もと 前 まえ 年 ねん 左右 さゆう 用 よう 造 づくり 与 あずか 金属 きんぞく 的 てき 合金 ごうきん
18世 せい 世 せい 来 らい 将 はた 毡帽 的 てき 皮 がわ 上 じょう 的 てき 毛 け 去 さ 制帽 せいぼう 工 こう 人中 ひとなか 了 りょう 在 ざい 青 あお 出 で 前 まえ 水 みず 梅毒 ばいどく
炼金术士认为汞是形成 けいせい 所有 しょゆう 金属 きんぞく 的 てき 第 だい 一物 いちもつ 他 た 不同 ふどう 的 てき 金属 きんぞく 可 か 由 よし 包含 ほうがん 的 てき 不同 ふどう 和 わ 的 てき 生成 せいせい 最 さい 金属 きんぞく 是 ぜ 金 きむ 要 よう 不 ふ 金属 きんぞく 基 もと 金属 きんぞく 到 いた 金的 きんてき 的 てき 目 め 世 せい 包括 ほうかつ 艾 もぐさ 牛 うし 在 ざい 内的 ないてき 著名 ちょめい 科学 かがく 家 か 都 と 相 しょう 信水 しんすい 金 きん [ 20] 化学 かがく 中 ちゅう 是 ぜ 符号 ふごう 自 じ 人造 じんぞう 的 てき 拉 ひしげ 丁 ひのと hydrargyrum ,其词根来 ねごろ 自 じ 希 まれ Ύδραργυρος (hydrargyros ),这个词的两个词根分 ぶん 表示 ひょうじ 水 みず Hydro )和 かず argyros ),由 ゆかり 水 すい 一 いち 液体 えきたい 又 また 像 ぞう 亮 あきら 在 ざい 西方 せいほう 人 にん 神 しん 墨 ぼく 丘 おか 利 とし 来 らい 命名 めいめい 墨 ぼく 丘 たかし 利 とぎ 的 てき 速度 そくど 和 わ 流 りゅう 著名 ちょめい 水星 すいせい 有 ゆう 天文学 てんもんがく 中 ちゅう 水星 すいせい 的 てき 符号 ふごう 的 てき 符号 ふごう 水 すい 星和 せいわ 名称 めいしょう 同 どう 梵文 ぼんぶん 中 ちゅう 叫 さけべ 意思 いし 是 ぜ 方式 ほうしき 唯一 ゆいいつ
自 じ 千 せん 五 ご 百 ひゃく 年 ねん 前 まえ 西 にし 班 はん 牙 きば 的 てき 阿 おもね 登 とう 采 さい 以来 いらい 意 い 大利 おおとし 的 てき 阿 おもね 米 べい 塔山 とうやま 和 かず 的 てき 斯洛文 ぶん 尼 あま 的 てき 伊 い 德 とく 里 さと 直 ちょく 到 いた 世 せい 了 りょう 新 しん 的 てき
1911年 ねん 荷 に 蘭 らん 科学 かがく 家 か 海 うみ 克 かつ 林 りん 昂 のぼる 用 よう 液 えき 氦 冷却 れいきゃく 當 とう 温度 おんど 下降 かこう 到 いた 絕對 ぜったい 溫 ぬる 標 しめぎ K 時水 ときみず 銀 ぎん 的 てき 電 でん 全 ぜん 消失 しょうしつ 現象 げんしょう 稱 たたえ 為 ため 超 ちょう 導電性 どうでんせい 溫度 おんど 稱 しょう 為 ため 超 ちょう 導 しるべ 臨界 りんかい 溫度 おんど
汞是地 ち 相当 そうとう 稀少 きしょう 的 てき 一 いち 元素 げんそ 只 ただ 有 ゆう 因 よし 的 てき 化学 かがく 性 せい 不易 ふえき 与 あずか 地 ち 量 りょう 元素 げんそ 成 なり 所以 ゆえん 考 こう 普通 ふつう 岩石 がんせき 中 ちゅう 的 てき 中 ちゅう 的 てき 富 とみ 集 しゅう 的 てき 品位 ひんい 最高 さいこう 的 てき 有 ゆう 的 てき 是 ぜ 即 そく 使 つかい 品位 ひんい 最低 さいてい 的 てき 也有 やゆう 是 ぜ 地 ち 的 てき 倍 ばい 金属 きんぞく 常 つね 朱 しゅ 砂 すな 氯硫汞矿 、硫汞锑矿 和 かず 砂 すな 最 さい 造山 つくりやま 高密度 こうみつど 的 てき 岩石 がんせき 被 ひ 地 ち 常 つね 温泉 おんせん 和 わ 火山 かざん 地区 ちく
大 だい 界 かい 上 じょう 的 てき 自 じ 西 にし 班 はん 牙 きば 和 わ 意 い 大利 おおとし 主要 しゅよう 是 ぜ 斯洛维尼亚 、俄 にわか 和 わ 北美 きたみ 朱 しゅ 砂 すな 在 ざい 流 りゅう 空 そら 加 か 的 てき 原 ばら 温度 おんど 降 くだ 低 てい 后 きさき 生 せい 的 てき 最 さい 主要 しゅよう 的 てき 方式 ほうしき
1554年 ねん 人 にん 明 あかり 了 りょう 用 よう 中 ちゅう 提 ひっさげ 取 ど 混 こん 年 ねん 西 にし 班 はん 牙 きば 和 わ 美 び 洲 しゅう 殖民 しょくみん 地 ち 的 てき 重要 じゅうよう 混 こん 被 ひ 用 よう 西 にし 班 はん 牙 きば 和 わ 秘 ひ 的 てき 起 おこり 初 はつ 西 にし 班 はん 牙 きば 王室 おうしつ 在 ざい 阿 おもね 登 とう 的 てき 提供 ていきょう 所有 しょゆう 殖民 しょくみん 地所 じしょ 后 きさき 来 らい 人 じん 美 び 洲 しゅう 了 りょう 在 ざい 年 ねん 秘 ひ 万卡韦利卡 地区 ちく 之 の 后 きさき 的 てき 三 さん 地区 ちく 了 りょう 超 ちょう 十 じゅう 万 まん 混 こん 和之 かずゆき 后 きさき 的 てき 盘内汞化法 ほう (Pan-amalgamation)对汞有 ゆう 巨大 きょだい 提 ひっさげ 取 ど 中 ちゅう 的 てき 情 じょう 直 ちょく 持 じ 世 せい 期 き
意 い 大利 おおとし 美国 びくに 和 わ 墨 ぼく 西 にし 的 てき 供 きょう 全 ぜん 世界 せかい 大 だい 部分 ぶぶん 的 てき 求 もとめ 被 ひ 完全 かんぜん 在 ざい 斯洛文 ぶん 尼 あま 和 わ 伊 い 德 とく 里 さと 和 わ 西 にし 班 はん 牙 きば 的 てき 阿 おもね 登 とう 因 いん 的 てき 下 か 被 ひ 内 うち 的 てき 麦 むぎ 克德 かつのり 米 べい 特 とく 是 ぜ 美国 びくに 最 さい 后 きさき 一 いち 年 ねん 波 は 十 じゅう 分 ふん 在 ざい 年 ねん 一 いち 千 せん 克 かつ 的 てき 格 かく 是 ぜ 美 び 元 もと
朱 しゅ 砂 すな 在 ざい 空 そら 中 ちゅう 被 ひ 加 か 反 はん 2 → Hg + SO2 然 しか 后 きさき 凝 しこり 蒸 ふけ 取 と
2005年 ねん 中国 ちゅうごく 是 ぜ 出 で 最多 さいた 的 てき 国家 こっか 占 うらない 全 ぜん 球 たま 市 し 三 さん 分 ふん 之 の 二 に 吉 よし 坦 ひろし 次 つぎ 之 の 国家 こっか 被 ひ 比 ひ 解 かい 的 てき 和 わ 水 すい 的 てき 提 ひさげ
欧 おう 盟 めい 的 てき 指令 しれい 要求 ようきゅう 到 いた 年 ねん 紧凑型 がた 灯 とう 变成强制 きょうせい 性 せい 要求 ようきゅう 一 いち 点 てん 中国 ちゅうごく 重 じゅう 新 しん 朱 しゅ 砂 すな 制 せい 造 づくり 型 がた 灯 とう 的 てき 的 てき 影 かげ 成 なり 的 てき 焦点 しょうてん 尤 ゆう 南方 なんぽう 的 てき 佛山 ほとけやま 广州 等 とう 城市 じょうし 和 わ 西南 せいなん 的 てき 贵州 省 しょう
废弃的 てき 往往 おうおう 有 ゆう 成 なり 堆 うずたか 的 てき 有害 ゆうがい 的 てき 朱 しゅ 砂 すな 的 てき 灰 はい 地方 ちほう 流 りゅう 水 すい 是 ぜ 的 てき 生 なま 来 らい 源 げん 旧 きゅう 的 てき 可能 かのう 可 か 建 けん 利用 りよう 年 ねん 加州 かしゅう 的 てき 圣塔克 かつ 拉 ひしげ 拉 ひしげ 郡 ぐん 了 りょう 史上 しじょう 的 てき 阿 おもね 登 とう 在 ざい 了 りょう 深入 ふかいり 的 てき 安全 あんぜん 和 わ 分析 ぶんせき 之 の 后 きさき 郡 ぐん 政府 せいふ 在原 ありはら 来 らい 的 てき 上面 うわつら 建立 こんりゅう 了 りょう 一座 いちざ 公 こう
汞有两种主要 しゅよう 尽 つき 管 かん 有 ゆう 声 ごえ 称 しょう 的 てき [ 21] 和 かず 化合 かごう 物 ぶつ 未知 みち [ 22] [ 23] 尽 つき 管 かん 短 たん 寿命 じゅみょう 的 てき 化合 かごう 物 ぶつ 可 か 化学 かがく [ 24]
与 あずか 同 どう 不同 ふどう 的 てき 是 ぜ 大 だい 多数 たすう 的 てき 化合 かごう 物 ぶつ 是 ぜ 反 はん 磁性 じせい 的 てき 形成 けいせい 二 に 子 こ 2 2+ 。稳定化合 かごう 物 ぶつ 包括 ほうかつ 硝酸 しょうさん 的 てき 物 ぶつ 可 か 强 きょう 例 れい 和 わ 等 とう 生成 せいせい 2+ 和 かず [ 25] 氯化亚汞 ,又 また 名 めい 甘汞 かんこう 是 ぜ 一 いち 色 しょく 固体 こたい 化学 かがく 式 しき 2 Cl2 ,原子 げんし 的 てき 方式 ほうしき 学 がく 中 ちゅう 的 てき 学 がく 中 ちゅう 与 あずか 反 はん 生成 せいせい 氢化亚汞 是 ぜ 一 いち 色 しょく 化学 かがく 式 しき 没 ぼつ 有 ゆう
汞易于与自身 じしん 形成 けいせい 多 た 例 れい 3 2+ (AsF6 - )2 中 なか 的 てき 3 2+ 。[ 26]
+2价是汞最常 つね 自然 しぜん 界 かい 中 ちゅう 非常 ひじょう 重要 じゅうよう 的 てき 一 いち 四 よん 化物 ばけもの 都 と 存在 そんざい 与 あずか 配合 はいごう 体 たい 形成 けいせい 正 せい 四 よん 面体 めんてい 的 てき 配合 はいごう 物 ぶつ 但 ただし 是 ぜ 与 あずか 形成 けいせい 的 てき 配合 はいごう 物 ぶつ 与 あずか 子 こ 最 さい 常 つね 是 ぜ 氯化汞 (又 また 称 たたえ 高 だか 升 しょう 是 ぜ 腐 くさ 的 てき 物品 ぶっぴん 通常 つうじょう 形成 けいせい 正 せい 四 よん 面体 めんてい 的 てき 配合 はいごう 物 ぶつ 例 れい 4 2- 。
氧化汞 是 ぜ 主要 しゅよう 的 てき 物 ぶつ 由 ゆかり 高温 こうおん 空 そら 接触 せっしょく 后 きさき 至近 しきん 分解 ぶんかい 成 なり 约瑟夫 おっと 普 ふ 里 さと 利 り 早期 そうき 制 せい 造 づくり 反 はん [ 12] 与 あずか 金 きむ 和 かず 情 じょう 似 に 人 にん 化物 ばけもの 了解 りょうかい
作 さく 软金属 きんぞく ,汞可以与较重的 てき 氧族元素 げんそ 形成 けいせい 的 てき 化合 かごう 物 ぶつ 非常 ひじょう 突出 とっしゅつ 的 てき 是 ぜ 硫化 りゅうか 硫化 りゅうか 自然 しぜん 界 かい 中 ちゅう 朱 しゅ 砂 すな 的 てき 形式 けいしき 出 で 是 ぜ 常用 じょうよう 印 しるし 泥 どろ 朱 しゅ 砂 すな 一 いち 石 せき 中 ちゅう 道士 どうし 的 てき 一種 いっしゅ 常用 じょうよう 材料 ざいりょう 与 あずか 硫化 りゅうか 硫化 りゅうか 有 ゆう 同 どう 形体 けいたい 分 ふん 的 てき 立方 りっぽう 晶 あきら 体 からだ 和 わ 黑色 こくしょく 的 てき 闪锌矿 结构晶 あきら 体 からだ [ 3] 后 きさき 者 しゃ 在 ざい 天然 てんねん 中 ちゅう metacinnabar 的 てき 形式 けいしき 存在 そんざい [ 27] 硒化汞 (HgSe)和 わ 碲化汞 (HgTe)也是已 やめ 知的 ちてき 和 わ 一 いち 生物 せいぶつ 例 れい 碲化汞镉 和 わ 碲化汞锌 ,都 みやこ 是 ただし 的 てき 红外线探测 材料 ざいりょう [ 28]
+2价汞的 てき 与 あずか 形成 けいせい 一 いち 系列 けいれつ 的 てき 生物 せいぶつ 包括 ほうかつ 米 まい 隆 たかし 2 N+ ),一 いち 高 だか 2 2+ )n ),易 えき 白 しろ 降 くだ 3 )2 ]Cl2 )。奈斯勒试剂 ,又 また 称 たたえ 用 よう 来 らい 存在 そんざい 因 いん 容易 ようい 反 はん 形成 けいせい 深 ふか 色 しょく 的 てき 米 よね 隆 たかし
雷 かみなり 酸 さん 是 ぜ [ 3] 用 よう 期 き 的 てき 雷管 らいかん 但 ただし 目前 もくぜん 已 やめ 被 ひ 更 さら 的 てき 起爆 きばく 代替 だいたい
高 こう 非 ひ 形 がた 在 ざい 化 か 反 はん 可能 かのう 会 かい 有 ゆう 代 だい 基 もと 的 てき 年 ねん 的 てき 物 ぶつ 被 ひ 合成 ごうせい 出来 でき 世 せい 年代 ねんだい 人声 ひとごえ 称 しょう 合成 ごうせい 出 で 了 りょう 的 てき 化合 かごう 物 ぶつ 但 ただし 是 ぜ 普遍 ふへん 假 かり 的 てき
在 ざい 上 じょう 有 ゆう 机 つくえ 化合 かごう 物 ぶつ 重要 じゅうよう 但 ただし 是 ぜ 在 ざい 西方 せいほう 世界 せかい 没 ぼつ 有 ゆう 工 こう 是 ぜ 的 てき 能 のう 直接 ちょくせつ 与 あずか 芳香 ほうこう 的 てき 金属 きんぞく 物 ぶつ 有 ゆう 机 つくえ 化合 かごう 物 ぶつ 二 に 配 はい 位 い 数 すう 一般 いっぱん 是 ぜ 形成 けいせい 直 ちょく 化合 かごう 物 ぶつ 与 あずか 有 ゆう 机 つくえ 化合 かごう 物 ぶつ 和 わ 有 ゆう 机 つくえ 化合 かごう 物 ぶつ 不同 ふどう 有 ゆう 机 つくえ 化合 かごう 物 ぶつ 不 ふ 与 あずか 水 みず 反 はん 有 ゆう 机 つくえ 化合 かごう 物 ぶつ 2 或 ある 的 てき 化合 かごう 物 ぶつ 前者 ぜんしゃ 多 た 易 えき 者 しゃ 多 た 体 たい 是 ぜ 芳 よし 基 もと 或 ある 烷基 ,X一般是卤素或乙酸根。甲 きのえ 基 はじめ 表示 ひょうじ 一 いち 系列 けいれつ 化学 かがく 式 しき 3 HgX的 てき 化合 かごう 物 ぶつ 甲 きのえ 基 はじめ 危害 きがい 非常 ひじょう 大 だい 出 で 被 ひ 污染 的 てき 河 かわ 流 りゅう 或 ある 湖 みずうみ 泊 はく 中 ちゅう [ 29] 甲 きのえ 基 はじめ 生物 せいぶつ 甲 きのえ 基 はじめ 化 か 作用 さよう
实验发现在 ざい 电弧 中 なか 惰性 だせい 可 か 生 せい 相互 そうご 作用 さよう 真正 しんせい 化学 かがく 反 はん 包 つつみ 合 ごう 物 ぶつ 和 わ 范德华力 相 あい
纯汞有 ゆう 毒 どく 化合 かごう 物 ぶつ 和 わ 盐 的 てき 毒性 どくせい 多数 たすう 非常 ひじょう 高 だか 口 くち 服 ふく 吸入 きゅうにゅう 或 ある 接触 せっしょく 后 きさき 可 か 脑 和 わ 肝 きも 故 こ 今 こん 天 てん 的 てき 温度 おんど 多数 たすう 使用 しよう 酒精 しゅせい 取 と 代 だい 但 ただし 因 よし 高 だか
在 ざい 標準 ひょうじゅん 氣溫 きおん 和氣 わき 壓 あつ 下 した 最大 さいだい 的 てき 是 ぜ 容易 ようい 氧化 而产生 せい 氧化汞 ,氧化汞容易 ようい 形成 けいせい 小 しょう 加 か 大 だい 表面 ひょうめん
虽然纯汞比 ひ 化合 かごう 物 ぶつ 的 てき 毒性 どくせい 低 てい 但 ただし 然 しか 是 ぜ 因 いん 在 ざい 生物 せいぶつ 体内 たいない 会 かい 形成 けいせい 有 ゆう 机 つくえ 化合 かごう 物 ぶつ
最 さい 的 てき 机 つくえ 化合 かごう 物 ぶつ 是 ぜ 二 に 甲 きのえ 基 はじめ 3 )2 Hg],仅数微 ほろ 升 ます 接触 せっしょく 在 ざい 皮 かわ 上 うえ 死 し
硫化 りゅうか 是 ぜ 毒性 どくせい 的 てき 化合 かごう 物 ぶつ
汞可以在生物 せいぶつ 体内 たいない 容易 ようい 被 かむ 皮 かわ 呼吸 こきゅう 道 どう 和 わ 消化 しょうか 道 どう 吸收 きゅうしゅう 水俣病 みなまたびょう 是 ぜ 中毒 ちゅうどく 的 てき 一 いち 中枢 ちゅうすう 神 しん 系統 けいとう 口 くち 粘膜 ねんまく 和 わ 牙 きば 有 ゆう 不良 ふりょう 影 かげ 暴露 ばくろ 在高 ありだか 境 さかい 中 ちゅう 可 か 和 わ 死亡 しぼう 尽 つき 管 かん 点 てん 但 ただし 在室 ざいしつ 内 ない 温度 おんど 下 か 的 てき 了 りょう 中毒 ちゅうどく 的 てき 数 すう 倍 ばい
因 いん 操作 そうさ 要 よう 特 とく 心 しん 盛 もり 容器 ようき 要 よう 特 とく 防止 ぼうし 出 で 或 ある 蒸 ふけ 加 か 或 ある 者 もの 易 えき 分解 ぶんかい 的 てき 化合 かごう 物 ぶつ 有 ゆう 的 てき 化合 かごう 物 ぶつ 即 そく 使 し 不 ふ 自 じ 原 げん 会 かい 蒸 ふけ 被 ひ 忽 ゆるがせ
如果汞洒出来 でき 例 れい 温度 おんど 或 ある 者 もの 荧光灯 とう 裡 うら 的 てき 要 よう 特 とく 步 ふ 吸收 きゅうしゅう 的 てき 接触 せっしょく 常用 じょうよう 的 てき 操作 そうさ 包括 ほうかつ 把 わ 小 しょう 的 てき 液 えき 滴 しずく 在 ざい 的 てき 物体 ぶったい 表面 ひょうめん 合成 ごうせい 大 だい 的 てき 液 えき 滴 しずく 可 か 便 びん 用 よう 滴 しずく 管 かん 清 きよし 除 じょ 柔 やわら 地 ち 把 わ 的 てき 一 いち 次 じ 性 せい 的 てき 容器 ようき 器 き 和 わ 不能 ふのう 使用 しよう 会 かい 造成 ぞうせい 物理 ぶつり 清 きよし 除 じょ 之 の 后 きさき 可 か 被 ひ 染 しみ 的 てき 区域 くいき 硫磺 粉 こな 或 ある 易 えき 与 あずか 室温 しつおん 下 か 形成 けいせい 合金 ごうきん 的 てき 粉末 ふんまつ 然 しか 后 きさき 再 さい 收集 しゅうしゅう 反 はん 善 ぜん 在 ざい 清 きよし 理 り 再 さい 清 きよし 理 り 多孔 たこう 的 てき 表面 ひょうめん 和 わ 衣服 いふく 裡 うら 残存 ざんそん 的 てき 效果 こうか 差 さ 了 りょう 所以 ゆえん
汞可以导致急性 せい 和 わ 慢性 まんせい 的 てき 中毒 ちゅうどく
在 ざい 嚴重 げんじゅう 的 てき 地區 ちく 能會 のうかい 隨 ずい 雨水 あまみず 落下 らっか 大氣 たいき 中大 ちゅうだい 部分 ぶぶん 的 てき 自 じ 東亞 とうあ [ 30]
工 こう 代 だい 以前 いぜん 的 てき 大 だい 中 なか 的 てき 速 そく 率 りつ 可能 かのう 是 ぜ 大 だい 每 ごと 升 ます 尽 つき 管 かん 速 そく 率 りつ 会 かい 当地 とうち 或 ある 者 もの 全 ぜん 球 たま 的 てき 来 らい 源 げん 的 てき 影 かげ 火山 かざん 爆 ばく 大 だい 的 てき 增加 ぞうか 到 いた 倍 ばい 大 だい 大 だい 例 れい 火山 かざん 人 ひと 生 せい 的 てき
65%来 き 自 じ 燃料 ねんりょう 的 てき 燃 もえ 煤 すす 的 てき 火力 かりょく 是 ぜ 最大 さいだい 的 てき 来 らい 源 げん 美国 びくに 年 ねん 的 てき 放 ひ 来 らい 源 みなもと 包括 ほうかつ 了 りょう 的 てき 天然 てんねん 裡 うら 未 み 被 ひ 清 きよし 除 じょ 的 てき 煤 すす 的 てき 燃 もえ 放 ひ 的 てき 油 ゆ 排 はい 放 ひ 的 てき 高 だか 各国 かっこく 具体 ぐたい 情 じょう 不同 ふどう
11%来 き 自 じ 金的 きんてき 生 せい 美国 びくに 最大 さいだい 的 てき 在 ざい 加 か 水 みず 化学 かがく 作用 さよう 的 てき 大 だい 重要 じゅうよう 来 き 源 げん
6.8%来 き 自 じ 非 ひ 金属 きんぞく 的 てき 生 なま 常 つね 源 げん 炉 ろ
6.4%来 き 自 じ 水泥 みどろ 的 まと 生 せい
3.0%来 き 自 じ 和 わ 的 てき 包括 ほうかつ 生活 せいかつ 和 わ 有害 ゆうがい 物的 ぶってき 火葬 かそう 下水道 げすいどう 的 てき
3.0%来 き 自 じ 氢氧化 か 的 まと 生 せい
1.4%来 き 自 じ 生 なま 和 わ 钢 的 まと 生 せい
1.1%来 き 自 じ 生 せい 主要 しゅよう 用 よう 池 ち
2.0%来 き 自 じ 所有 しょゆう 来 らい 源 げん
以上 いじょう 的 てき 年 ねん 人 じん 放 ひ 的 てき 不 ふ 包括 ほうかつ 生物 せいぶつ 燃料 ねんりょう 燃 もえ 排 はい 放 ひ
溫度 おんど 計 けい 中 なか 的 てき 各 かく 式 しき 各樣 かくよう 的 てき 日光 にっこう 燈 とう 汞最常用 じょうよう 的 てき 應用 おうよう 是 ぜ 造 づくり 工業 こうぎょう 用 よう 化學 かがく 藥物 やくぶつ 在 ざい 電子 でんし 或 ある 電器 でんき 產品 さんぴん 中 ちゅう 獲得 かくとく 應用 おうよう 用 よう 溫度 おんど 計 けい 尤 ゆう 在 ざい 測量 そくりょう 高溫 こうおん 的 てき 溫度 おんど 計 けい 越来 ごえく 越 えつ 多 た 的 てき 氣 き 態 たい 用 よう 製造 せいぞう 日光 にっこう 燈 とう 多 た 的 てき 應用 おうよう 都 と 因 いん 影響 えいきょう 健康 けんこう 和 わ 安全 あんぜん 的 てき 問題 もんだい 淘汰 とうた 取 と 之 これ 的 てき 是 ぜ 毒性 どくせい 弱 じゃく 但 ただし 多 た 的 てき 镓铟锡合金 きん 。除 じょ 外 がい 用途 ようと 還 かえ 有 ゆう
汞齊牙 きば 齒 ぱ 填補 てんぽ 物 ぶつ 汞和它的化合 かごう 物 ぶつ 汞齊 對 たい 病 びょう 全的 ぜんてき 是 ぜ 尽 つき 管 かん 不 ふ 前 ぜん 那 な 因 いん 在 ざい 化合 かごう 物 ぶつ 的 てき 毒性 どくせい 已 やめ 更 さら 地 ち 知 ち 憂 ゆう 心 こころ 在 ざい 高溫 こうおん 時 じ 會 かい 蒸發 じょうはつ 出 で 硫柳汞 是 ぜ 尽 つき 管 かん 使用 しよう 已 やめ 被 ひ 禁止 きんし 化合 かごう 物 ぶつ 汞溴红 ,是 ぜ 用 よう 微小 びしょう 切口 きりくち 和 わ 表面 ひょうめん 在 ざい 某 ぼう 国家 こっか 被 ひ 使用 しよう
硫柳汞 (Thiomersal)廣 こう 製造 せいぞう 染 しみ 眉毛 まゆげ 膏 あぶら 在 ざい 年 ねん 美國 びくに 明 あかり 尼 あま 蘇 そ 達 いたる 州 しゅう 成 なり 為 ため 美國 びくに 第 だい
2013年 ねん 月 がつ 10日 とおか 由 ゆかり 联合国 こく 署 しょ 主 しゅ 外交 がいこう 会 かい 在 ざい 日本 にっぽん 熊本 くまもと 市 し 表 おもて 旨 むね 在 ざい 控 ひかえ 制 せい 和 わ 全 ぜん 球 たま 放 ひ 的 てき 关于汞的水俣 みなまた 公 こう 》。该公约的名字 みょうじ 是 ぜ 在 ざい 熊本 くまもと 市 し 的 てき 水俣病 みなまたびょう 国家 こっか 和 わ 地区 ちく 的 てき 代表 だいひょう 共同 きょうどう 了 りょう 公 おおやけ [ 31]
在 ざい 台灣 たいわん 的 てき 食用 しょくよう 油脂 ゆし 食品 しょくひん 衛生 えいせい 管理 かんり 標準 ひょうじゅん 中 ちゅう 最大 さいだい 容 よう 許 もと 量 りょう 為 ため [ 32]
美国 びくに 国家 こっか 保 ほ 染 しみ 的 てき 控 ひかえ 制 せい 和 わ 管理 かんり 有 ゆう 法律 ほうりつ 了 りょう 包括 ほうかつ 空 そら Clean Air Act (United States) 水 みず 体 たい 清 きよし Clean Water Act 资源保 ほ 回收 かいしゅう 法 ほう (Resource Conservation and Recovery Act 和 わ 饮水安全 あんぜん 法 ほう (Safe Drinking Water Act 年 ねん 通 どおり 含汞电池和 わ 可 か 充 たかし 池 ち 管理 かんり 法 ほう (Mercury-Containing and Rechargeable Battery Management Act 中 ちゅう 要求 ようきゅう 淘汰 とうた 的 てき 使用 しよう 提供 ていきょう 了 りょう 多 た 型 がた 的 てき 的 てき 有效 ゆうこう 的 てき 方式 ほうしき [ 33] 年 ねん 的 てき 数 すう 据 すえ 中 ちゅう 北美 きたみ 地区 ちく 的 てき 放 ひ 量 りょう 全 ぜん 球 たま 的 てき [ 34]
在 ざい 欧 おう 盟 めい 限 きり 制 せい 在 ざい 和 わ 中 ちゅう 使用 しよう 有害 ゆうがい 物 ぶつ 指令 しれい 参 まいり 危害 きがい 性 せい 物 ぶつ 制 せい 指令 しれい 要求 ようきゅう 在 ざい 某 ぼう 子 こ 和 わ 中 ちゅう 禁止 きんし 使用 しよう 中 ちゅう 也有 やゆう 量 りょう 不 ふ 得 とく 超 ちょう ppm 的 まと 限 げん 制 せい 表 ひょう 中 ちゅう 亦 また 針 はり 對 たい 照明 しょうめい 光源 こうげん 光 こう 燈 とう 管 かん 等 とう 訂 てい 定 じょう 分 ぶん 階段 かいだん 實施 じっし 之 の 更 さら 嚴格 げんかく 的 てき 量 りょう 限 げん 制 せい [ 35] 包装 ほうそう 中 ちゅう 有 ゆう 一定 いってい 的 てき 限 きり 制 せい 铅 ,六 ろく 和 わ 镉 的 てき 限 げん 制 せい 中 ちゅう 物 ぶつ 鈕 ぼたん 電池 でんち [ 36] 年 ねん 月 がつ 起 おこり 欧 おう 盟 めい 禁止 きんし 非 ひ 量 りょう 的 てき 使用 しよう 温度 おんど 禁令 きんれい 只 ただ 医 い 包含 ほうがん 了 りょう [ 37]
2008年 ねん 月 がつ 日 にち 頒布 はんぷ 對 たい 在 ざい 製造 せいぞう 業 ぎょう 上 じょう 的 てき 使用 しよう 和 わ 品 ひん 的 てき 進出 しんしゅつ 口 こう 行為 こうい 完全 かんぜん 禁止 きんし 的 てき 法令 ほうれい [ 38] 在 ざい 年 ねん 某 ぼう 威 い 的 てき 湖 みずうみ 泊 はく 被 ひ 發現 はつげん 染 しみ [ 39]
2008年 ねん 環境 かんきょう 部 ぶ 部長 ぶちょう 表示 ひょうじ 前 まえ 已 やめ 有 ゆう 更 さら 好 こう 代替 だいたい 物 ぶつ 因 いん 的 てき 使用 しよう 將 はた 被 ひ 禁止 きんし [ 40]
瑞 みず 典 てん 年 ねん 禁止 きんし 使用 しよう [ 41] [ 42]
丹 に 麦 むぎ 年 ねん 起 おこり 在 ざい 牙 きば 科 か 中 ちゅう 禁止 きんし 使用 しよう [ 40]
根 ね 据 すえ 年 ねん 月 がつ 日 にち 环境保 ほ 印 しるし 关于汞的水俣 みなまた 公 こう 〉生 なま 效 こう 公告 こうこく 将 はた 自 じ 年 ねん 月 がつ 日 にち 生 せい 效 こう [ 43]
2020年 ねん 月 がつ 中國 ちゅうごく 国家 こっか 局在 きょくざい 布 ぬの 国家 こっか 局 きょく 司 し 履行 りこう 水俣 みなまた 公 こう 通知 つうち 宣布 せんぷ 自 じ 年 ねん 月 がつ 日 にち 起 おこり 中国 ちゅうごく 将 しょう 全面 ぜんめん 禁止 きんし 生 せい 体温 たいおん 血 ち [ 44]
2021年 ねん 日 にち 起 おこり 根據 こんきょ 香港 ほんこん 法例 ほうれい 第 だい 章 しょう 管制 かんせい 條例 じょうれい 任 にん 何人 なんにん 進 しん 口 こう 或 ある 出口 でぐち 條例 じょうれい 附 ふ 表 ひょう 第 だい 部 ぶ 化學 かがく 品 ひん 第 だい 部 ぶ 化學 かがく 品 ひん 即 そく 混合 こんごう 物 ぶつ 或 ある 存 そん 放 ひ 或 ある 使用 しよう 條例 じょうれい 附 ふ 表 ひょう 第 だい 部 ぶ 化學 かがく 品 ひん 第 だい 部 ぶ 化學 かがく 品 ひん 必須 ひっす 領有 りょうゆう 環 たまき 保 たもつ 署 しょ 發出 はっしゅつ 的 てき 許可 きょか 證 しょう [ 45] [ 46]
鱼和贝类通常 つうじょう 会 かい 甲 きのえ 基 はじめ 的形 まとがた 体内 たいない 富 とみ 集 しゅう 甲 きのえ 基 はじめ 甲 きのえ 基 はじめ 是 ぜ 脂 あぶら 溶性 ようせい 的 てき 所以 ゆえん 主要 しゅよう 富 とみ 集 しゅう 尽 つき 管 かん 所有 しょゆう 的 てき 肌 はだ 肉 にく 中也 ちゅうや 都 と 含有 がんゆう 食物 しょくもつ 的 てき 例 れい 海豚 いるか 旗 はた 国王 こくおう 金 きん 金 きん 和 わ 方 かた 体内 たいない 的 てき 量 りょう 会 かい 高 だか 物 ぶつ 端 はし 的 てき 和 わ 当 とう 体内 たいない 含有 がんゆう 被 ひ 捕食 ほしょく 会 かい 在 ざい 捕食 ほしょく 者 しゃ 内 ない 体内 たいない 累 るい 排出 はいしゅつ 甲 きのえ 基 はじめ 速度 そくど 低 てい 集 しゅう 的 てき 速度 そくど 所以 ゆえん 中 ちゅう 的 てき 量 りょう 会 かい 升 ます 高 だか 食物 しょくもつ 端 はし 的 てき 体内 たいない 量 りょう 可 か 被 ひ 食用 しょくよう 的 てき 体内 たいない 量的 りょうてき 十 じゅう 倍 ばい 叫 さけべ 生物 せいぶつ 放 ひ 大 だい 作用 さよう 或 ある 者 もの 生物 せいぶつ 富 とみ 集 しゅう 作用 さよう 日本 にっぽん 的 てき 水俣 みなまた 市 し 因 いん 生 せい 中毒 ちゅうどく 的 てき 事件 じけん 由 よし 中毒 ちゅうどく 的 てき 神 しん 病 びょう 被 ひ 称 しょう 作 さく 水俣病 みなまたびょう
^ "Magnetic susceptibility of the elements and inorganic compounds" (页面存 そん ,存 そん 互联网档案 あん ) in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5 ^ Weast, Robert. CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. 1984: E110. ISBN 0-8493-0464-4 ^ 3.0 3.1 3.2 3.3 Hammond, C. R The Elements 互联网档案 あん 的 てき 存 そん 存 そん 期 き Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
^ 4.0 4.1 Senese, F. Why is mercury a liquid at STP? . General Chemistry Online at Frostburg State University. [2007-05-01 ] . (原始 げんし 内容 ないよう 存 そん ^ 5.0 5.1 Norrby, L.J. Why is mercury liquid? Or, why do relativistic effects not get into chemistry textbooks? . Journal of Chemical Education. 1991, 68 (2): 110. Bibcode:1991JChEd..68..110N S2CID 96003717 doi:10.1021/ed068p110 ^ Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press: 4.125–4.126, 2005, ISBN 0-8493-0486-5 ^ Dynamic Periodic Table . www.ptable.com. [2016-11-22 ] . (原始 げんし 内容 ないよう 存 そん ^ Simons, E. N. Guide to Uncommon Metals. Frederick Muller. 1968: 111. ^ Werner Siemens, Vorschlag eines reproducirbaren Widerstandsmaaßes, Annalen der Physik und Chemie. 1860, 186 (5): pp. 1–20, (德 とく 文 ぶん ^ Robert B. Northrop. Introduction to Instrumentation and Measurements, Third Edition . CRC Press. 2014-06-04: 20–. ISBN 978-1-4665-9679-5 ^ 11.0 11.1 宋 そう 天佑 てんゆう 徐 じょ 家 か 寧 やすし 程 ほど 功 こう 王 おう 無機 むき 化學 かがく 第 だい 四 よん 版 はん 下 しも 冊 さつ 年 ねん 月 がつ 第 だい 三 さん 刷 さつ 北京 ぺきん 高等 こうとう 教育 きょういく 出版 しゅっぱん 社 しゃ 744 . ISBN 978-7-04-052146-7(中 ちゅう 文 ぶん 中国 ちゅうごく 大 だい . ^ 12.0 12.1 Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements . 2016. ISBN 978-0-7506-3365-9OCLC 1040112384 (英 えい . ^ High Oxidation States: Mercury tetrafluoride synthesized . [2012-08-22 ] . (原始 げんし 内容 ないよう 存 そん ^ Elusive Hg (IV) species has been synthesized under cryogenic conditions . 2007-10-12 [2012-08-22 ] . (原始 げんし 内容 ないよう 存 そん ^ Riedel, Sebastian; Kaupp, Martin. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews (Elsevier BV). 2009, 253 (5-6): 606–624. ISSN 0010-8545 doi:10.1016/j.ccr.2008.07.014 ^ Gmelin, Leopold. Hand book of chemistry . Cavendish Society. 1852: 103 (Na), 110 (W), 122 (Zn), 128 (Fe), 247 (Au), 338 (Pt) [2012-12-30 ] . (原始 げんし 内容 ないよう 存 そん ^ Soratur. Essentials of Dental Materials . Jaypee Brothers Publishers. 2002: 14. ISBN 978-81-7179-989-3原始 げんし 内容 ないよう 存 そん ^ Vargel, C.; Jacques, M.; Schmidt, M. P. Corrosion of Aluminium . Elsevier. 2004: 158 [2021-12-24 ] . ISBN 9780080444956原始 げんし 内容 ないよう 存 そん ^ 司 つかさ 史 ふみ 卷 まき 始皇帝 しこうてい [2016-11-25 ] . (原始 げんし 内容 ないよう 存 そん (中 ちゅう 文 ぶん . 以水銀 すいぎん 為 ため 百川 ももがわ 江河 こうが 大海 たいかい 機 き 相 しょう 上 うえ 具 ぐ 天文 てんもん 下 した 具 ぐ 地理 ちり ^ 约翰·艾 もぐさ 利 り 致命 ちめい 元素 げんそ 三 さん 店 てん ISBN 978-7-108-03993-4(中 ちゅう 文 ぶん . ^ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin. Mercury Is a Transition Metal: The First Experimental Evidence for HgF4 . Angew. Chem. Int. Ed. 2007, 46 (44): 8371–8375. PMID 17899620 doi:10.1002/anie.200703710 ^ Rooms, J. F.; Wilson, A.V.; Harvey, I.; Bridgeman, A.J.; Young, N. A. Mercury-fluorine interactions: a matrix isolation investigation of Hg... F2 , HgF2 and HgF4 in argon matrices. Phys Chem Chem Phys. 2008, 10 (31): 4594–605. Bibcode:2008PCCP...10.4594R PMID 18665309 doi:10.1039/b805608k ^ Riedel, S.; Kaupp, M. The Highest Oxidation States of the Transition Metal Elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014 ^ Deming, Richard L.; et al. Tripositive mercury. Low temperature electrochemical oxidation of 1,4,8,11-tetraazacyclotetradecanemercury(II) tetrafluoroborate . Journal of the American Chemical Society. 1976, 98 (14): 4132–4137 [2021-12-25 ] . doi:10.1021/ja00430a020 原始 げんし 内容 ないよう 存 そん ^ Henderson, W. Main group chemistry . Great Britain: Royal Society of Chemistry. 2000: 162. ISBN 978-0-85404-617-1原始 げんし 内容 ないよう 存 そん ^ Brown, I. D.; Gillespie, R. J.; Morgan, K. R.; Tun, Z.; Ummat, P. K. Preparation and crystal structure of mercury hexafluoroniobate (Hg ) and mercury hexafluorotantalate (Hg ): mercury layer compounds. Inorganic Chemistry. 1984, 23 (26): 4506–4508. doi:10.1021/ic00194a020 ^ 引用 いんよう 没 ぼつ 有 ゆう metacinnabar的 てき 参考 さんこう 文献 ぶんけん 提供 ていきょう 内容 ないよう ^ Rogalski, A. Infrared detectors . CRC Press. 2000: 507 [2021-12-25 ] . ISBN 978-90-5699-203-3原始 げんし 内容 ないよう 存 そん ^ National Research Council (U.S.) – Board on Environmental Studies and Toxicology. Toxicological effects of methylmercury . National Academies Press. 2000 [2021-12-25 ] . ISBN 978-0-309-07140-6原始 げんし 内容 ないよう 存 そん ^ 存 そん 副本 ふくほん [2005-12-14 ] . (原始 げんし 内容 ないよう 存 そん ^ 联合国 こく 水俣 みなまた 公 こう 在 ざい 日本 にっぽん 熊本 くまもと . 人民 じんみん [2013-10-11 ] . (原始 げんし 内容 ないよう 存 そん ^ 食品 しょくひん 藥物 やくぶつ 消費 しょうひ 者 しゃ 知識 ちしき 服務 ふくむ 網 もう 食品 しょくひん 法規 ほうき 條文 じょうぶん [2014-02-07 ] . (原始 げんし 内容 ないよう 存 そん ^ Mercury: Laws and regulations . 美国 びくに 国家 こっか 保 ほ [2008-05-30 ] . (原始 げんし 内容 ないよう 存 そん ^ Reductions in Mercury Emissons . International Joint Commission on the Great Lakes . [2012-10-10 ] . (原始 げんし 内容 ないよう 存 そん ^ Directive on the Restriction of the Use of Certain Hazardous Substances in Electrical and Electronic Equipment . 2002/95/EC [2012-10-10 ] . (原始 げんし 内容 ないよう 存 そん ^ Mercury compounds in European Union: . EIA Track . 2007 [2008-05-30 ] . (原始 げんし 内容 ないよう 存 そん ^ Jones H. EU bans mercury in barometers, thermometers . Reuters. 2007-07-10 [2008-05-30 ] . (原始 げんし 内容 ないよう 存 そん ^ Norway to ban mercury . EU Business . 2007-12-21 [2008-05-30 ] . (原始 げんし 内容 ないよう 存 そん ^ Berg, T; Fjeld, E; Steinnes, E. Atmospheric mercury in Norway: contributions from different sources. The Science of the total environment. 2006, 368 (1): 3–9. PMID 16310836 doi:10.1016/j.scitotenv.2005.09.059 ^ 40.0 40.1 Banning Mercury Amalgam in the United States (PDF) . [2014-02-07 ] . (原始 げんし 内容 ないよう 存 そん (PDF) 于2013-11-01). ^ Sweden to ban mercury - The Local . Thelocal.se. [2014-02-07 ] . (原始 げんし 内容 ないよう 存 そん ^ Sweden may be forced to lift ban on mercury - The Local . Thelocal.se. [2014-02-07 ] . (原始 げんし 内容 ないよう 存 そん ^ 《关于汞的水俣 みなまた 公 こう 生 なま 效 こう 公告 こうこく . www.mee.gov.cn. [2019-10-25 ] . (原始 げんし 内容 ないよう 存 そん ^ 2026年 ねん 起 おこり 全面 ぜんめん 禁止 きんし 生 せい 体温 たいおん . [2020-10-20 ] . (原始 げんし 内容 ないよう 存 そん ^ 存 そん 副本 ふくほん [2023-01-09 ] . (原始 げんし 内容 ないよう 存 そん ^ 存 そん 副本 ふくほん [2023-01-09 ] . (原始 げんし 内容 ないよう 存 そん