卟 ( bǔ ) 啉 ( lín ) 英語 えいご Porphyrin )又 また 称 しょう 紫 むらさき 是 ぜ 一 いち 四 よん 吡咯 类亚基 もと 的 てき α あるふぁ 原子 げんし 通 どおり 次 つぎ 甲 きのえ 基 はじめ 形成 けいせい 的 てき 大分 おおいた 子 こ 杂环化合 かごう 物 ぶつ 。其母体 ぼたい 化合 かごう 物 ぶつ 卟吩 (porphin ,C20 H14 N4 ),有 ゆう 取 と 代 だい 基 もと 的 てき 即 そく 称 しょう π ぱい 是 ぜ 深 ふか 色 しょく porphyrin 的 てき 音 おと 文名 ぶんめい porphyra ),意 い 色 しょく 因 いん 被 ひ 称 しょう 作 さく 紫 むらさき 旧称 きゅうしょう 因 いん 旧称 きゅうしょう 化合 かごう 物 ぶつ [1]
许多卟啉以与金属 きんぞく 配合 はいごう 的 てき 形式 けいしき 存在 そんざい 自然 しぜん 界 かい 中 ちゅう 含有 がんゆう 二 に 与 あずか 位 い 的 てき 叶 かのう 位 い 的 てき 血 ち 人体 じんたい 内 ない 造成 ぞうせい 病 びょう 紫 むらさき
性 せい [ 编辑 ]
卟吩-最 さい 簡單 かんたん 的 てき
卟吩的 てき 空間 くうかん 填 はま 充 たかし 模型 もけい
四苯基卟啉的结构
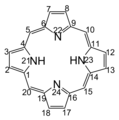
卟啉环的编号系 けい
卟啉环的编号方式 ほうしき 命名 めいめい 是 ぜ 将 しょう 位 い 称 たたえ meso 位 くらい 将 はた 位 い 称 たたえ alpha 位 くらい α あるふぁ 将 はた 位 い 称 たたえ beta 位 くらい β べーた
卟啉的 てき 大分 おおいた 子 こ 一 いち 中心 ちゅうしん 的 てき 体系 たいけい 符合 ふごう 休 きゅう 克 かつ 中 なか 的 てき 通 つう 式 しき 因 いん 具有 ぐゆう 芳香 ほうこう 性 せい 自由 じゆう 中心 ちゅうしん 原子 げんし 可 か 或 ある 金属 きんぞく 子 こ 配 はい 位 い 的 てき 原子 げんし 被 ひ 金属 きんぞく 取 と 代 だい 生成 せいせい 金属 きんぞく 通常 つうじょう 把 わ 生物 せいぶつ 称 しょう 金属 きんぞく 化合 かごう 物 ぶつ 式 しき
H
2
(
{\displaystyle {\rm {H_{2}(\,}}}
)
+
[
M
L
n
]
2
+
→
M
(
{\displaystyle {\rm {)+[ML_{n}]^{2+}\rightarrow M(\,}}}
)
L
n
−
4
+
4
L
+
2
H
+
{\displaystyle {\rm {)L_{n-4}+4L+2H^{+}\,}}}
四苯并四氮杂卟啉类化合物由苯酐 与 あずか 尿素 にょうそ 在 ざい 氯化亚铜 存在 そんざい 下 か 制 せい 得 え 呈 てい 一般 いっぱん 称 しょう 酞菁 。其分子中 こなか 四 よん 异吲哚 环的氮原子 げんし 可 か 金属 きんぞく 在 ざい 中心 ちゅうしん 配 はい 位 い 生成 せいせい 金属 きんぞく 金属 きんぞく 化合 かごう 物色 ぶっしょく 晒 さらし 耐 たい 性能 せいのう 着色 ちゃくしょく 力强 ちからづよ 是 ぜ 常用 じょうよう 的 てき 和 わ 染料 せんりょう
以卟啉作为结构单元 もと 的 てき 超 ちょう 分子 ぶんし 是 ぜ 目前 もくぜん 分子 ぶんし 器 き 件 けん 研究 けんきゅう 的 てき 主要 しゅよう 方向 ほうこう 之 の 一 いち meso -四 よん 的 てき 氯化铁 配合 はいごう 物 ぶつ 是 ぜ 的 てき 生物 せいぶつ 有 ゆう 咕啉 、二 に 二 に 菌 きん 綠 みどり 素 もと F430 (镍四吡咯)等 とう
自然 しぜん 形成 けいせい [ 编辑 ] 地 ち 是 ぜ [2] 可能 かのう 出 で 原油 げんゆ 油 あぶら 煤 すすけ 或 ある 岩 がん 中 ちゅう [2] [3] 卟啉鎳石 可能 かのう 是 ぜ 唯 ただ 因 いん 少 しょう 出 で 形成 けいせい 晶 あきら 体 たい [4]
合成 ごうせい [ 编辑 ] 实验室 しつ 合成 ごうせい [ 编辑 ] 对甲基 もと 与 あずか 吡咯 在 ざい 丙 へい 酸 さん 中 ちゅう 回流 かいりゅう 反 はん 得 え 到 いた 的 てき meso -四 よん 晶 あきら 体 からだ [5] 实验室 しつ 中 ちゅう 通常 つうじょう 是 ぜ 用 よう 取 と 代 がわ 醛 类和吡咯 在 ざい 酸 さん 中 ちゅう 的 てき 反 はん 合成 ごうせい 的 てき 一般 いっぱん 需要 じゅよう 用 よう 路 みち 易 えき 反 はん 不 ふ 高 こう 反 はん 会 かい 大量 たいりょう 的 てき 副 ふく 可 か 色 しょく 除去 じょきょ 金属 きんぞく 溴化亚铁 )作用 さよう 可 か 到 いた 相 あい 金属 きんぞく
这个合成 ごうせい 的 てき 方法 ほうほう 或 ある 阿 おもね 德 とく 年 ねん 首 くび 先 さき 合成 ごうせい 四 よん [6] [7] 他 た 采 さい 用 よう 吡啶 为溶剂,使 つかい 苯甲醛 和 かず 在 ざい 封 ふう 管 かん 中 ちゅう 加 か 十 じゅう 小 しょう 可 か 参与 さんよ 反 はん 生物 せいぶつ 后 きさき 来 らい 方法 ほうほう 被 ひ 和 わ 作 さく 了 りょう 深入 ふかいり 研究 けんきゅう [8] 改 あらため 丙 へい 酸 さん 作 さく 介 かい 使 つかい 芳香 ほうこう 回流 かいりゅう 反 はん 冷却 れいきゃく 用 よう 和 わ 甲 きのえ 醇 あつし 分 ぶん 真空 しんくう 干 ひ 体 たい 得 とく 到 いた 与 あずか 的 てき 方法 ほうほう 相 しょう 比 ひ 改 あらため 可 か 得 とく 的 てき 操作 そうさ 的 てき 取 と 代 だい 因 いん
间-四烷基卟啉可由相应醛(比 ひ 多 た 一 いち 与 あずか 回流 かいりゅう 反 はん 要用 ようよう DDQ )或 ある 的 てき 原 げん 可用 かよう 对甲苯磺酸 さん 作 さく 的 てき
生物 せいぶつ 合成 ごうせい [ 编辑 ] 生物 せいぶつ 体内 たいない 的 てき 合成 ごうせい 柠檬酸 さん 中 なか 的 てき 琥珀 こはく 与 あずか 甘 あま 作原 さくはら 料 りょう Claisen缩合 并脱 だつ 生成 せいせい δ でるた 乙 おつ 酸 さん 然 しか 后 きさき 分子 ぶんし 的 てき δ でるた 乙 おつ 酸 さん 生成 せいせい 的 てき 胆 きも 色素 しきそ 原 ばら 胆 きも 色素 しきそ 原 はら 脱 だつ 作用 さよう 下 か 羟甲基 もと 胆 きも 素 もと (HMB),继续反 はん 到 いた 尿 にょう 原 ばら 出 で 四 よん 的 てき 框 かまち 架 か 尿 にょう 原 ばら 之 これ 后 きさき 又 また 先後 せんご 粪卟啉原Ⅲ 、原 はら 原 ばら 和 わ 原 はら 分 ぶん 出 で 了 りょう 血 ち 和 わ 叶 かのう 的 てき 合成 ごうせい 系 けい
在 ざい 一 いち 光 こう 合 ごう 生物 せいぶつ 动物 、真 ま 菌 きん 非 ひ 光 ひかり 合 あい 原生 げんせい 生物 せいぶつ 中 ちゅう 的 てき α あるふぁ 菌 きん 中 ちゅう 合成 ごうせい 的 てき 關 せき 鍵 かぎ 步 ふ 是 ぜ 由 ゆかり 琥珀 こはく 与 あずか 甘 あま 合成 ごうせい δ でるた 乙 おつ 酸 さん
參 まいり 見 み [ 编辑 ] 参考 さんこう [ 编辑 ]
^ 《汉语大 だい 字典 じてん 条目 じょうもく
^ 2.0 2.1 Karl M. Kadish (编). The Porphyrin Handbook . Elsevier . 1999: 381 [2022-06-05 ] . ISBN 9780123932006原始 げんし 内容 ないよう 存 そん ^ Zhang, Bo; Lash, Timothy D. Total synthesis of the porphyrin mineral abelsonite and related petroporphyrins with five-membered exocyclic rings. Tetrahedron Letters. September 2003, 44 (39): 7253. doi:10.1016/j.tetlet.2003.08.007 ^ Mason, G. M.; Trudell, L. G.; Branthaver, J. F. Review of the stratigraphic distribution and diagenetic history of abelsonite . Organic Geochemistry. 1989, 14 (6): 585. doi:10.1016/0146-6380(89)90038-7 ^ Falvo, RaeAnne E.; Mink, Larry M.; Marsh, Diane F. Microscale Synthesis and 1 H NMR Analysis of Tetraphenylporphyrins. J. Chem. Educ.: 237. ^ P. Rothemund. A New Porphyrin Synthesis. The Synthesis of Porphin. J. Am. Chem. Soc. 1936, 58 (4): 625–627. doi:10.1021/ja01295a027 ^ P. Rothemund. Formation of Porphyrins from Pyrrole and Aldehydes. J. Am. Chem. Soc. 1935, 57 (10): 2010–2011. doi:10.1021/ja01313a510 ^ A. D. Adler, F. R. Longo, J. D. Finarelli, J. Goldmacher, J. Assour and L. Korsakoff. A simplified synthesis for meso-tetraphenylporphine. J. Org. Chem. 1967, 32 (2): 476–476. doi:10.1021/jo01288a053






![{\displaystyle {\rm {)+[ML_{n}]^{2+}\rightarrow M(\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/df3fb79b6903aa7dba31a90c017a045ff205fa94)
