薁
| 薁 | |
|---|---|

| |

| |
| IUPAC Azulene | |
bicyclo[5.3.0]decapentaene Azulene[1] | |
| 别名 | 蓝烃、 |
| 识别 | |
| CAS |
275-51-4 |
| PubChem | 9231 |
| ChemSpider | 8876 |
| SMILES |
|
| InChI |
|
| InChIKey | CUFNKYGDVFVPHO-UHFFFAOYAT |
| EINECS | 205-993-6 |
| ChEBI | 31249 |
| RTECS | CO4570000 |
| KEGG | C13392 |
| C10H8 | |
| 128.17 g·mol⁻¹ | |
| 无[3] | |
| 1.037 g/cm3 | |
| 熔点 | 99 °C(372 K)([2]) |
| 242 °C(515 K)([5]) | |
| 几乎 | |
| -98.5·10−6 cm3/mol[4] | |
| 热力 | |
| −1266.5 kcal/mol[6] | |
| 危险 | |
| 警示术语 | R:R51/53 |
| S:S61 | |
| 闪点 | 76.66 °C |
化学 性 质
[编辑]

薁是一种含有七元环与五元环的稠环
薁在
合成
[编辑]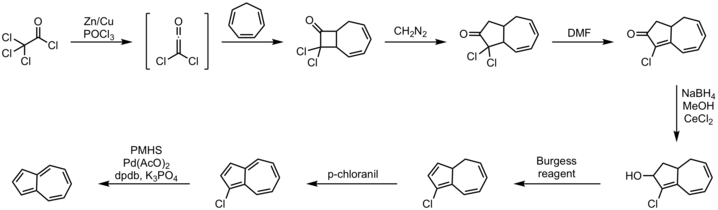
- 环庚
三 烯和 三 氯乙酰氯生成 的 二 氯乙烯酮的 2+2 环加成 反 应 重 氮甲烷的 插入 反 应用 二甲基甲酰胺脱 卤化氢用 硼氢化 钠通 过Luche还原反 应还原成 醇 伯 吉 斯试剂的 消 除 反 应四 氯对苯醌氧化用 聚甲基 氢硅氧烷、乙 酸 钯、磷酸钾和 DPDB配 体 脱 卤
薁配合 物
[编辑]相 关化合 物
[编辑]1-羟基薁是
參考 資料
[编辑]- ^ International Union of Pure and Applied Chemistry. Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. 2014: 207. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069.
- ^ 2.0 2.1 Entry on Azulene. at: Römpp Online. Georg Thieme Verlag, retrieved 2019-02-14.
- ^ 3.0 3.1 3.2 Datenblatt Azulene, 99% bei AlfaAesar, abgerufen am {{{Abruf}}}.
- ^ Sweet, L. I.; Meier, P. G. Lethal and Sublethal Effects of Azulene and Longifolene to Microtox®, Ceriodaphnia dubia, Daphnia magna, and Pimephales promelas (PDF). Bulletin of Environmental Contamination and Toxicology. 1997, 58 (2): 268–274 [2021-08-30]. PMID 8975804. doi:10.1007/s001289900330. hdl:2027.42/42354
 . (
. (原始 内容 存 档 (PDF)于2012-03-30). - ^
来 源 :Sigma-Aldrich Co., product no. a97203 .. [2021-09-15] - ^ Salter, Carl; Foresman, James B. Naphthalene and Azulene I: Semimicro Bomb Calorimetry and Quantum Mechanical Calculations. Journal of Chemical Education. 1998, 75 (10): 1341. Bibcode:1998JChEd..75.1341S. doi:10.1021/ed075p1341.
- ^ Harmon, A. D.; Weisgraber, K. H.; Weiss, U. Preformed azulene pigments of Lactarius indigo (Schw.) Fries (Russulaceae, Basidiomycetes). Experientia. 1980, 36: 54–56. S2CID 21207966. doi:10.1007/BF02003967.
- ^ Anderson, Arthur G.; Steckler, Bernard M. Azulene. VIII. A Study of the Visible Absorption Spectra and Dipole Moments of Some 1- and 1,3-Substituted Azulenes. Journal of the American Chemical Society. 1959, 81 (18): 4941–4946. doi:10.1021/ja01527a046.
- ^ Michl, Joseph; Thulstrup, E. W. Why is azulene blue and anthracene white? A simple mo picture. Tetrahedron. 1976, 32 (2): 205. doi:10.1016/0040-4020(76)87002-0.
- ^ Tétreault, N.; Muthyala, R. S.; Liu, R. S. H.; Steer, R.P. Control of the Photophysical Properties of Polyatomic Molecules by Substitution and Solvation: The Second Excited Singlet State of Azulene. Journal of Physical Chemistry A. 1999, 103 (15): 2524–31. Bibcode:1999JPCA..103.2524T. doi:10.1021/jp984407q.
- ^ Gordon, Maxwell. The Azulenes. Chemical Reviews. 1 February 1952, 50 (1): 127–200. doi:10.1021/cr60155a004.
- ^ St. Pfau, Alexander; Plattner, Pl. A. Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens. Helvetica Chimica Acta. 1939, 22: 202–208. doi:10.1002/hlca.19390220126.
- ^ Hafner, Klaus; Meinhardt, Klaus-Peter. Azulene. Organic Syntheses. 1984, 62: 134. doi:10.15227/orgsyn.062.0134.
- ^ Carret, Sébastien; Blanc, Aurélien; Coquerel, Yoann; Berthod, Mikaël; Greene, Andrew E.; Deprés, Jean-Pierre. Approach to the Blues: A Highly Flexible Route to the Azulenes. Angewandte Chemie International Edition. 2005, 44 (32): 5130–5133. PMID 16013070. doi:10.1002/anie.200501276.
- ^ Lemal, David M.; Goldman, Glenn D. Synthesis of azulene, a blue hydrocarbon. Journal of Chemical Education. 1988, 65 (10): 923. Bibcode:1988JChEd..65..923L. doi:10.1021/ed065p923.
- ^ Churchill, Melvyn R. Transition Metal Complexes of Azulene and Related Ligands. Progress in Inorganic Chemistry. 2007: 53–98. ISBN 9780470166123. doi:10.1002/9780470166123.ch2.
- ^ Asao, Toyonobu; Shunji Ito; Noboru Morita. 1-Hydroxyazulene and 3-hydroxyguaiazulene: Synthesis and their properties. Tetrahedron Letters. 1989, 30 (48): 6693–6696. doi:10.1016/S0040-4039(00)70653-8.
- ^ 18.0 18.1 Takase, Kahei; Toyonobu Asao; Yoshikazu Takagi; Tetsuo Nozoe. Syntheses and some properties of 2- and 6-hydroxyazulenes. Chemical Communications. 1968, (7): 368b–370. doi:10.1039/C1968000368B.
- ^ Yamamura, Kimiaki; Kawabata, Shizuka; Kimura, Takatomo; Eda, Kazuo; Hashimoto, Masao. Novel Synthesis of Benzalacetone Analogues of Naphth[a]azulenes by Intramolecular Tropylium Ion-Mediated Furan Ring-Opening Reaction and X-ray Investigation of a Naphth[1,2-a]azulene Derivative. The Journal of Organic Chemistry. 2005, 70 (22): 8902–6. PMID 16238325. doi:10.1021/jo051409f.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
