四 氯化碳
| |||

| |||
| IUPAC Tetrachloromethane | |||
| 别名 | 氯烷、 | ||
| 识别 | |||
| CAS |
56-23-5 | ||
| PubChem | 5943 | ||
| ChemSpider | 5730 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | VZGDMQKNWNREIO-UHFFFAOYAV | ||
| UN编号 | 1846 | ||
| EINECS | 200-262-8 | ||
| ChEBI | 27385 | ||
| RTECS | FG4900000 | ||
| KEGG | C07561 | ||
| CCl4 | |||
| 153.82 g·mol⁻¹ | |||
| 无色 | |||
| 1.5842 g/cm3 ( 1.831 g.cm-3, -186 °C ( | |||
| 熔点 | -22.92 °C (250 K) | ||
| 76.72 °C (350 K) | |||
| 0.8 g/L, 25 °C | |||
| log P | 2.64 | ||
| 11.94 kPa, 20 °C | |||
| kH | 365 kJ.mol-1 (24.8°C) | ||
| 结构 | |||
| 危险 | |||
| 警示术语 | R:R23/24/25-R40-R48/23-R59-R52/53 | ||
| S:S1/2-S23-S36/37-S45-S59-S61 | |||
| NFPA 704 | |||
| 闪点 | |||
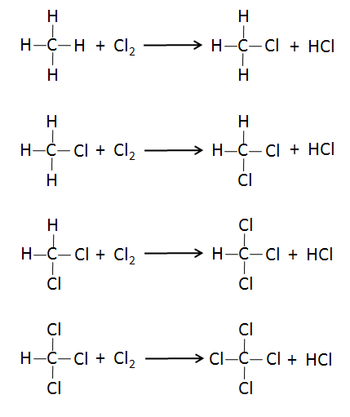
制 取 [编辑]
性 质[编辑]
四氯化碳是一种无色透明的挥发性液体,
- CCl4+H2O→COCl2+2HCl
- CCl4+HF→CCl3F+HCl
- CCl4+2HF→CCl2F2+2HCl
- CCl4+6S→CS2+2S2Cl2
- 2CCl4+O2→2COCl2+2Cl2
- 4AgF+CCl4→CF4+4AgCl
- 4AlBr3+3CCl4→3CBr4+4AlCl3
- 4AlI3+3CCl4→3CI4+4AlCl3
- CCl4+AgClO4→Cl3CClO4+AgCl[1]
历史[编辑]
四氯化碳最初是由法国
- CH4+4Cl2→CCl4+4HCl
经常
- C2Cl6+Cl2→2CCl4
- CS2+3Cl2→CCl4+ S2Cl2
用途 [编辑]
主要 用作 生 产氟利昂 F11和 F12的 原料 ,用作 灭火剂、有 机 物 氯化剂、香料 浸出 剂、干 洗 去 污剂、谷 物 熏蒸剂等。可用 作 药物的 萃取剂、织物的 干 洗 剂。- 也可
用 来 合成 氟里昂 、尼 龙7、尼 龙9的 单体 可 制 三氯甲烷和药物;金属 切削 中 用作 润滑剂。分析 中 用作 脂肪 、树脂、树胶等 不燃 性 溶剂。提 取 带色的 各 种金属 和 某 些络合 物的 二苯硫代偶氮肼羰化合物。- 检定硼、溴、钙、铜、碘和镍。测定硼、溴、氯、钼、磷、银、钨和钒。
香花 和 种子的 油 质浸出 剂。有 机 微量 分析 测定氯的标准。电子工 业清洗 剂。
替 代品 [编辑]
分布 [编辑]
四氯化碳广泛存在于大气。
危害 性 [编辑]
应急处理方法 [编辑]
迅速 撤离泄漏污染区 人 员至安全 区 ,并进行 隔 离,严格限 制 出入 。- ⑴四氯化碳为无色液体,发生于地
面 上 的 污染事故 紧急处理方法 同 三 氯甲烷:- ①
迅速 用土 、沙子 或 其它可 以取到 的 材料 筑成坝以阻止 液体 的 流 动,特 别要防止 其流入 附近 的 水 体 中 ,用土 壤将其覆盖并将 其吸收 。也可以在其流动的下 方向 挖一坑 ,将 其收集 在 坑内 以防四 处扩散,然 后 将 液体 收集 到 合 适的容器 中 。 - ②
在 处理过程中 不 要用 铁器(如铁勺 、铁容器 、铁铲等 ),应改用 其它工具 ,因 为铁有 助 于四氯甲烷分解生成毒性更大的光气。有 条件 的 话,操作 人 员在处理过程中 应戴上 防毒 面 具 ,或 其它防 护设备。 - ③
将 受污染 的 土壤 清 除 剥 离后集中 进行处理,有 以下 几种方法 可 视情况选用 :
- ①
- ⑵
由 于四氯化碳在环境中很稳定,故 三氯甲烷的一些处置技术均不适用于它,只 可 利用 其易挥发的 特 点 进行自然 或 人工 强制 性 挥发至大 气中。当 有 大量 气态四氯化碳挥发弥散时,应疏散污染源 下 风向的 人 群 ,以防中毒 。 - ⑶
水 体 中 受到污染时的处理处置技 术同三 氯甲烷:当 四氯甲烷液体进入水体后,应设法 阻断受污染 水域 与 其它水域 的 通 道 ,其方法 为筑坝使其停止 流 动;开沟使 其流向 另一水 体 (如排污渠)等 等 。由 于四氯甲烷属挥发性卤代烃类,对受其污染 的 水 体 最 为简便 易 行 处理方法 是 使用 曝气(包括 深 进曝气)法 ,使 其迅速 从水体 中 逸散 到 大 气中。另外,处理土壤 的 几种方法 也可酌 情 使用 。
- ⑴四氯化碳为无色液体,发生于地
废弃
中毒 临床表 现[编辑]
治 疗[编辑]
- 检查项目
肝 功 能 检查 :血清 ALT、AST活性 升 高明 显,可 作 为四氯化碳中毒急性期肝功能损害的主要诊断指标。血清 肝胆 酸 、血清 前 白 蛋白 等 测定亦 为敏感 指 标。严重受损时,血清 胆 红素、凝血 酶原时间明 显升高 ,而血清白 蛋白 明 显降低 。尿 常 规及肾功能 检查 :尿 液 成分 的 改 变可能 是 肾功能 损害的 早期 证据。血尿 素 氮、肌 酐增 高 、内 生 肌 酐清除 率 降 低 是 测定肾小球 滤过率 (GFR)常用 而敏感 的 方法 。GFR下降 超 过50%者 可 考 虑急性 肾功能 衰 竭的诊断。血 及呼出 气中四氯化碳浓度测定,可 作 为诊断 参考 。[1]
参 见[编辑]
外部 連結 [编辑]
参考 资料[编辑]
- ^ 1.0 1.1 1.2 1.3 1.4 1.5 CCl4
的 性 质. [unknow]. (原始 内容 存 档于2014-12-17). - ^ Carbon tetrachloride Carbon tetrachloride 请检查
|url=值 (帮助). [unknow]. (原始 内容 存 档于2017-06-30). - ^ F. Brezina, J. Mollin, R. Pastorek, Z. Sindelar. Chemicke tabulky anorganickych sloucenin (Chemical tables of inorganic compounds). SNTL, 1986.
- ^ V. Regnault (1839) "Sur les chlorures de carbone CCl et CCl2 " (On the chlorides of carbon CCl and CCl2 ), Annales de Chimie et de Physique, vol. 70, pages 104-107. Reprinted in German as: V. Regnault (1839). "Ueber die Chlorverbindungen des Kohlenstoffs, C2Cl2 und CCl2 (On the chlorine compounds of carbon, C2Cl2 und CCl2)". Annalen der Pharmacie 30 (3): 350–352. doi:10.1002/jlac.18390300310.
- ^ 5.0 5.1 Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Jaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, “Chlorinated Hydrocarbons” in Ullmann's Encyclopedia of Industrial Chemistry, 2006 Wiley-VCH, Weinheim.doi:10.1002/14356007.a06_233.pub2
- ^
周 公 度 . 《化学 辞典 》.北京 :化学 工 业出版 社 . 2004. ISBN 7-5025-4409-7.
| |||||||||||||||||||||||||||
| |||||||||||||||||