出典 しゅってん 百科 ひゃっか 事典 じてん
過 か 臭素 しゅうそ 酸 さん 臭素 しゅうそ オキソ酸 さん の一種 いっしゅ 化学 かがく 式 しき HBrO4 の化合 かごう 物 ぶつ 臭素 しゅうそ 原子 げんし 酸化 さんか 数 すう 最高 さいこう 酸化 さんか 状態 じょうたい 名称 めいしょう 過 か 付 つ 分子 ぶんし 内 ない 結合 けつごう 過 か 酸 さん
形式 けいしき 的 てき 七 なな 酸化 さんか 二 に 臭素 しゅうそ 2 O7 )と水 みず 反応 はんのう 七 なな 酸化 さんか 二 に 臭素 しゅうそ 自体 じたい 現在 げんざい 安定 あんてい 得 え 過 か 臭素 しゅうそ 酸 さん 不安定 ふあんてい 強酸 きょうさん 過 か 塩素 えんそ 酸 さん 性質 せいしつ 似 に 強 つよ 酸化 さんか 力 りょく 遊離 ゆうり 状態 じょうたい 純粋 じゅんすい 酸 さん 得 え
かつては過 か 臭素 しゅうそ 酸 す 過 か 臭素 しゅうそ 酸 さん 存在 そんざい 存在 そんざい 理由 りゆう 理論 りろん 的 てき 説明 せつめい 学術 がくじゅつ 論文 ろんぶん 出 だ 始末 しまつ 1968年 ねん にようやく合成 ごうせい 至 いた [ 1]
最初 さいしょ 放射 ほうしゃ 性 せい 同位 どうい 体 たい セレン 原子 げんし 含 ふく セレン酸 さん のβ べーた 崩壊 ほうかい 過 か 臭素 しゅうそ 酸 さん 生成 せいせい 見出 みいだ [ 2]
SeO
4
2
−
83
→
β べーた −
83
BrO
4
−
{\displaystyle {\ce {^{83}SeO4^{2-}\ ->[\beta -]\ ^{83}BrO4^-}}}
化学 かがく 実験 じっけん 室 しつ 合成 ごうせい 臭素 しゅうそ 酸 さん 塩 しお 二 に 化 か 酸化 さんか 方法 ほうほう 濃厚 のうこう 臭素 しゅうそ 酸 さん 水溶液 すいようえき 塩基 えんき 性 せい 条件 じょうけん 冷却 れいきゃく フッ素 ふっそ 酸化 さんか 方法 ほうほう 実用 じつよう 的 てき [ 3]
BrO
3
−
+
XeF
2
+
H
2
O
⟶
BrO
4
−
+
2
HF
+
Xe
{\displaystyle {\ce {BrO3^- \ + XeF2\ + H2O -> BrO4^- \ + 2 HF\ + Xe}}}
BrO
3
−
+
F
2
+
2
OH
−
⟶
BrO
4
−
+
2
F
−
+
H
2
O
{\displaystyle {\ce {BrO3^- \ + F2\ + 2 OH^- -> BrO4^- \ + 2 F^- \ + H2O}}}
得 え 溶液 ようえき 未 み 反応 はんのう 臭素 しゅうそ 酸 さん 臭素 しゅうそ 酸 さん 銀 ぎん 3 )として、フッ化物 ばけもの をフッ化 か (CaF2 )の沈殿 ちんでん 除 のぞ 陽 ひ イオン交換 こうかん 樹脂 じゅし を通 とお 遊離 ゆうり 酸 さん 水溶液 すいようえき 得 え
過 か 臭素 しゅうそ 酸 さん 熱 ねつ 力学 りきがく 的 てき 不安定 ふあんてい 極 きわ 強 つよ 酸化 さんか 剤 ざい 反応 はんのう 速度 そくど 論 ろん 的 てき 比較的 ひかくてき 安定 あんてい 酸性 さんせい 水溶液 すいようえき 中 なか 標準 ひょうじゅん 酸化 さんか 還元 かんげん 電位 でんい 以下 いか 通 とお
BrO
4
−
(
aq
)
+
2
H
+
(
aq
)
+
2
e
−
=
BrO
3
−
(
aq
)
+
H
2
O
(
l
)
,
{\displaystyle {\ce {BrO4^{-}(aq)\ +2H^{+}(aq)\ +2{\mathit {e}}^{-}\ =\ BrO3^{-}(aq)\ +H2O(l)\ ,}}}
E
∘
=
1.76
V
{\displaystyle E^{\circ }={\rm {1.76V}}}
過 か 臭素 しゅうそ 酸 さん 水溶液 すいようえき 減圧 げんあつ 濃縮 のうしゅく 可能 かのう mol dm-3 (約 やく 程度 ていど 水溶液 すいようえき 以下 いか 比較的 ひかくてき 安定 あんてい 減圧 げんあつ 濃縮 のうしゅく -3 (約 やく 程度 ていど 水溶液 すいようえき 水 みず 和物 あえもの
HBrO
4
⋅
2
H
2
O
,
H
3
O
+
⋅
BrO
4
−
⋅
H
2
O
,
H
5
O
2
+
⋅
BrO
4
−
{\displaystyle {\ce {HBrO4\cdot 2H2O\ ,H3O^{+}\cdot BrO4^{-}\cdot H2O\ ,H5O2^{+}\cdot BrO4^{-}}}}
結晶 けっしょう 得 え 不安定 ふあんてい 塩化 えんか 物 ぶつ 酸化 さんか 有機物 ゆうきぶつ 接触 せっしょく 爆発 ばくはつ 的 てき 燃焼 ねんしょう [ 1] [ 3]
また水溶液 すいようえき 中 ちゅう 過 か 塩素 えんそ 酸 さん 同様 どうよう 著 いちじる 強酸 きょうさん
HBrO
4
(
aq
)
+
H
2
O
(
l
)
⇄
H
3
O
+
(
aq
)
+
BrO
4
−
(
aq
)
{\displaystyle {\ce {HBrO4(aq)\ +H2O(l)\ \rightleftarrows \ H3O^{+}(aq)\ +BrO4^{-}(aq)}}}
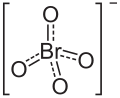
過 か 臭素 しゅうそ 酸 さん 4 - )は過 か 臭素 しゅうそ 酸 さん 電離 でんり 生成 せいせい 過 か 臭素 しゅうそ 酸 さん 塩 しお 中 ちゅう 存在 そんざい 価 か 陰 かげ 過 か 塩素 えんそ 酸 さん 同様 どうよう 正 せい 四 よん 面体 めんてい 型 かた 構造 こうぞう 結合 けつごう 距離 きょり
過 か 臭素 しゅうそ 酸 さん 塩 しお 過 か 臭素 しゅうそ 酸 さん 含 ふく イオン結晶 けっしょう であり、過 か 臭素 しゅうそ 酸 さん 比較的 ひかくてき 安定 あんてい 分解 ぶんかい 酸素 さんそ 放 はな 臭素 しゅうそ 酸 さん 3 )となり、過 か 臭素 しゅうそ 酸 さん 安定 あんてい [ 1]
^ a b c FA コットン, G. ウィルキンソン著 ちょ 中原 なかはら 勝 まさる 儼 げん 訳 やく 無機 むき 化学 かがく 培風館 ばいふうかん 年 ねん 原書 げんしょ
^ 『化学 かがく 辞典 じてん 東京 とうきょう 化学 かがく 同人 どうじん 年 ねん
^ a b 日本 にっぽん 化 か 学会 がっかい 編 へん 新 しん 実験 じっけん 化学 かがく 講座 こうざ 無機 むき 化合 かごう 物 ぶつ 合成 ごうせい 丸善 まるぜん 年 ねん




![{\displaystyle {\ce {^{83}SeO4^{2-}\ ->[\beta -]\ ^{83}BrO4^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/709d471ad2716d03ce308d0f4af6dd3a0c0f6e44)





