出典 しゅってん 百科 ひゃっか 事典 じてん
炭酸 たんさん 英 えい carbonic acid )は、化学 かがく 式 しき 2 CO3 で表 あらわ 炭素 たんそ オキソ酸 さん であり弱酸 じゃくさん 一種 いっしゅ
普通 ふつう 水溶液 すいようえき 炭酸 たんさん 水 すい 中 ちゅう 存在 そんざい 水 みず 溶解 ようかい 二酸化炭素 にさんかたんそ 一部 いちぶ 水分 すいぶん 子 こ 反応 はんのう 炭酸 たんさん
CO
2
(
aq
)
+
H
2
O
(
l
)
↽
−
−
⇀
H
2
CO
3
(
aq
)
{\displaystyle {\ce {CO2(aq)\ +H2O(l)\ <=>\ H2CO3(aq)}}}
この反応 はんのう 平衡 へいこう 定数 ていすう K h ) は 25 ℃で 1.7 × 10−3 であり[ 1] 著 いちじる 左 ひだり 偏 かたよ 水溶液 すいようえき 中 ちゅう 二酸化炭素 にさんかたんそ 大 だい 部分 ぶぶん 2 分子 ぶんし 存在 そんざい 触媒 しょくばい 存在 そんざい 場合 ばあい 二酸化炭素 にさんかたんそ 炭酸 たんさん 間 あいだ 反応 はんのう 平衡 へいこう 達 たっ 速度 そくど 低 ひく 正 せい 反応 はんのう 速度 そくど 定数 ていすう −1 、逆 ぎゃく 反応 はんのう 速度 そくど 定数 ていすう −1 である。
二酸化炭素 にさんかたんそ 炭酸 たんさん 平衡 へいこう 体液 たいえき 酸性 さんせい 度 ど 調節 ちょうせつ 上 じょう 非常 ひじょう 重要 じゅうよう 生物 せいぶつ 化合 かごう 物 ぶつ 変換 へんかん 炭酸 たんさん 脱水 だっすい 酵素 こうそ 持 も 酵素 こうそ 反応 はんのう 速度 そくど 億 おく 倍 ばい [要 よう 出典 しゅってん にする。
炭酸 たんさん 水溶液 すいようえき 中 ちゅう 段階 だんかい 解離 かいり 起 お 酸 さん 解離 かいり 定数 ていすう 段階 だんかい 目 め K a1 = 3.60、2段階 だんかい 目 め K a2 = 10.25 であり、炭酸 たんさん 真 しん 解離 かいり 定数 ていすう 酢酸 さくさん 強 つよ 酸 さん 上記 じょうき 二酸化炭素 にさんかたんそ 平衡 へいこう 存在 そんざい 見 み 上 じょう K a* が高 たか 非常 ひじょう 弱 よわ 酸 さん 炭酸 たんさん 塩 しお 相応 そうおう 塩基 えんき 性 せい 示 しめ 灰汁 あく 古代 こだい 日常 にちじょう 生活 せいかつ 洗浄 せんじょう 活用 かつよう
H
2
CO
3
(
aq
)
↽
−
−
⇀
HCO
3
−
(
aq
)
+
H
+
(
aq
)
{\displaystyle {\ce {H2CO3(aq) <=> HCO3^{-}(aq) + H^+(aq)}}}
HCO
3
−
(
aq
)
↽
−
−
⇀
CO
3
2
−
(
aq
)
+
H
+
(
aq
)
{\displaystyle {\ce {HCO3^{-}(aq) <=> CO3^{2-}(aq) + H^+(aq)}}}
K
a
1
=
[
H
+
]
[
HCO
3
−
]
[
H
2
CO
3
]
=
2.5
×
10
−
4
{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}=2.5\times 10^{-4}}
酸 さん 解離 かいり 関 かん 標準 ひょうじゅん エンタルピー 変化 へんか ギブス自由 じゆう 変化 へんか エントロピー 変化 へんか 値 ね 報告 ほうこく [ 2] 解離 かいり 伴 ともな 減少 げんしょう 電荷 でんか 増加 ぞうか 伴 ともな 水 みず 和 わ 程度 ていど 増加 ぞうか 電 でん 縮 ちぢみ 起 お 水 みず 分子 ぶんし 水素 すいそ 結合 けつごう 秩序 ちつじょ 化 か 度合 どあ 増加 ぞうか [ 3] 値 ね 以下 いか 平衡 へいこう 対 たい K a1 *は見 み 酸 さん 解離 かいり 定数 ていすう
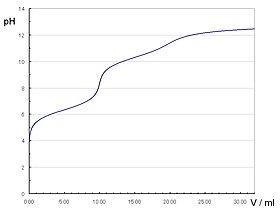
水酸化 すいさんか 水溶液 すいようえき 中和 ちゅうわ 滴 しずく 定 てい 曲線 きょくせん
CO
2
(
aq
)
+
H
2
O
(
l
)
↽
−
−
⇀
H
+
(
aq
)
+
HCO
3
−
(
aq
)
{\displaystyle {\ce {CO2(aq) + H_2O(l) <=> H^+(aq) + HCO_3^{-}(aq)}}}
p
K
a
1
∗
=
6.35
{\displaystyle {\mbox{p}}K_{a1}^{*}=6.35\,}
HCO
3
−
(
aq
)
↽
−
−
⇀
H
+
(
aq
)
+
CO
3
2
−
(
aq
)
{\displaystyle {\ce {HCO_3^{-}(aq) <=> H^+(aq) + CO_3^{2-}(aq)}}}
p
K
a
2
=
10.33
{\displaystyle {\mbox{p}}K_{a2}=10.33\,}
K
a
1
∗
=
[
H
+
]
[
HCO
3
−
]
[
H
2
CO
3
]
+
[
CO
2
]
=
4.45
×
10
−
7
{\displaystyle K_{a1}^{*}={\frac {[{\mbox{H}}^{+}][{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]+[{\mbox{CO}}_{2}]}}=4.45\times 10^{-7}}
K
a
2
=
[
H
+
]
[
CO
3
2
−
]
[
HCO
3
−
]
=
4.7
×
10
−
11
{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{CO}}_{3}^{2-}]}{[{\mbox{HCO}}_{3}^{-}]}}=4.7\times 10^{-11}}
Δ でるた
H
∘
{\displaystyle {\mathit {\Delta }}H^{\circ }}
Δ でるた
G
∘
{\displaystyle {\mathit {\Delta }}G^{\circ }}
Δ でるた
S
∘
{\displaystyle {\mathit {\Delta }}S^{\circ }}
Δ でるた
C
p
∘
{\displaystyle {\mathit {\Delta }}Cp^{\circ }}
第 だい 一 いち 解離 かいり 7.64 kJ mol−1
36.34 kJ mol−1
−96.3 J mol−1 K−1
−377 J mol−1 K−1
第 だい 二 に 解離 かいり 14.85 kJ mol−1
58.96 kJ mol−1
−148.1 J mol−1 K−1
−272 J mol−1 K−1
長 なが 間 あいだ 炭酸 たんさん 水 みず 溶 と 状態 じょうたい 存在 そんざい 炭酸 たんさん 室温 しつおん 単 たん 離 はなれ 不可能 ふかのう 考 かんが 年 ねん ゴダード宇宙 うちゅう 飛行 ひこう の科学 かがく 者 しゃ 初 はじ 純粋 じゅんすい 2 CO3 を作 つく 出 だ 成功 せいこう [ 4] 彼 かれ 凍結 とうけつ 水 みず 二酸化炭素 にさんかたんそ 高 こう 放射線 ほうしゃせん 照射 しょうしゃ 加 か 温 ぬく 余分 よぶん 水 みず 取 と 除 のぞ 単 たん 離 はなれ 行 おこな 得 え 炭酸 たんさん 構造 こうぞう 赤 あか 外 がい 分光 ぶんこう 法 ほう 検証 けんしょう 宇宙 うちゅう 空間 くうかん 水 みず 二酸化炭素 にさんかたんそ 氷 こおり 普通 ふつう 存在 そんざい 実験 じっけん 結果 けっか 宇宙 うちゅう 線 せん 紫外線 しがいせん 反応 はんのう 生成 せいせい 炭酸 たんさん 宇宙 うちゅう 空間 くうかん 存在 そんざい 可能 かのう 性 せい 示唆 しさ
理論 りろん 計算 けいさん 水 みず 分子 ぶんし 存在 そんざい 炭酸 たんさん 二酸化炭素 にさんかたんそ 水 みず 戻 もど 水 みず 含 ふく 純粋 じゅんすい 炭酸 たんさん 気体 きたい 状態 じょうたい 安定 あんてい 示 しめ 半減 はんげん 期 き 万 まん 年 ねん 考 かんが [ 5]
大気 たいき 中 ちゅう 二酸化炭素 にさんかたんそ 溶 と 込 こ 水 みず 通常 つうじょう 雨水 あまみず 二酸化炭素 にさんかたんそ 飽和 ほうわ 状態 じょうたい 大気 たいき 汚染 おせん 物質 ぶっしつ 前後 ぜんこう 工場 こうじょう 排出 はいしゅつ 二酸化 にさんか 硫黄 いおう 酸性 さんせい 酸化 さんか 物 ぶつ 溶 と 込 こ 二酸化炭素 にさんかたんそ 飽和 ほうわ 雨水 あまみず 低下 ていか 酸性 さんせい 雨 う 呼 よ 雨 あめ チョーク や石灰岩 せっかいがん 炭酸 たんさん 塩 しお 鉱物 こうぶつ 影響 えいきょう 様々 さまざま 地形 ちけい 作 つく 出 だ 岩石 がんせき 含 ふく 炭酸 たんさん 二酸化炭素 にさんかたんそ 溶解 ようかい 水 みず 間 あいだ 以下 いか 平衡 へいこう 成 な 立 た
CaCO
3
+
CO
2
+
H
2
O
↽
−
−
⇀
Ca
(
HCO
3
)
2
{\displaystyle {\ce {CaCO3\ +CO2\ +H2O\ <=>\ Ca(HCO3)2}}}
(
CaCO
3
(
s
)
+
CO
2
(
aq
)
+
H
2
O
(
l
)
↽
−
−
⇀
Ca
2
+
(
aq
)
+
2
HCO
3
−
(
aq
)
)
{\displaystyle {\ce {(CaCO3(s)\ +CO2(aq)\ +H2O(l)\ <=>\ Ca^{2+}(aq)\ +2HCO3^{-}(aq))}}}
これにより、水 みず 入 はい 断層 だんそう 線 せん 付近 ふきん 地下 ちか 洞窟 どうくつ 浸食 しんしょく 水 みず 蒸発 じょうはつ 二酸化炭素 にさんかたんそ 溶解 ようかい 度 ど 低下 ていか 炭酸 たんさん 再 さい 結晶 けっしょう 鍾乳石 しょうにゅうせき 石筍 せきじゅん 形成 けいせい 帯 おび 水 すい 層 そう 上 あ 水 みず 多量 たりょう 炭酸 たんさん 溶解 ようかい 硬水 こうすい 呼 よ
^ Welch, M. J.; Lipton, J. F.; Seck, J. A. (1969). "Tracer studies with radioactive oxygen-15. Exchange between carbon dioxide and water". J. Phys. Chem. 73 : 3351–3356. DOI: 10.1021/j100844a033
^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
^ 田中 たなか 元治 もとはる 基礎 きそ 化学 かがく 選書 せんしょ 酸 さん 塩基 えんき 裳 も 華 はな 房 ぼう 年 ねん ^ Moore, M. H.; Khanna, R. (1991). "Infrared and Mass Spectral Studies of Proton Irradiated H2O + CO2 Ice: Evidence for Carbonic Acid". Spectrochim. Acta [A] 47 : 255–262.
^ Loerting, T.; Tautermann, C.; Kroemer, R. T.; Kohl, I.; Mayer, E.; Hallbrucker, A.; Leidl, K. R. (2000). "On the Surprising Kinetic Stability of Carbonic Acid". Angew. Chem., Int. Ed. 39 : 891–894. DOI: 10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E
ウィキメディア・コモンズには、
炭酸 たんさん に
関連 かんれん するカテゴリがあります。
酸化 さんか 物 ぶつ 誘導体 ゆうどうたい イオン化合 かごう 物 ぶつ






![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]}}=2.5\times 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db3d52a848e9718ad7edbfc0b64dd7c31aa8d37a)




![{\displaystyle K_{a1}^{*}={\frac {[{\mbox{H}}^{+}][{\mbox{HCO}}_{3}^{-}]}{[{\mbox{H}}_{2}{\mbox{CO}}_{3}]+[{\mbox{CO}}_{2}]}}=4.45\times 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c747823775b3471c53f0dd9e49830c176b2acbd)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{CO}}_{3}^{2-}]}{[{\mbox{HCO}}_{3}^{-}]}}=4.7\times 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c019d2460b9b31ba2498924a72c759151cfd3a8d)





