此條目 め 之 の 中立 ちゅうりつ 性 せい 有 ゆう 争 そう 容 よう 語調 ごちょう 可能 かのう 帶 おび 有明 ありあけ 顯 あらわ 的 てき 個人 こじん 觀點 かんてん 或 ある 地方 ちほう 色彩 しきさい (2024年 ねん 月 がつ 日 にち ) 加 か 上 じょう 板 いた 的 てき 編輯 へんしゅう 者 しゃ 討論 とうろん 頁 ぺーじ 說明 せつめい 中立 ちゅうりつ 性 せい 有 ゆう 爭議 そうぎ 的 てき 原因 げんいん 讓 ゆずる 各 かく 編輯 へんしゅう 者 しゃ 討論 とうろん 和 わ 改善 かいぜん 在 ざい 編輯 へんしゅう 之 の 前 ぜん 看 み
水 みず 是 ぜ 一 いち 色 しょく 的 てき 化合 かごう 物 ぶつ 分子 ぶんし 式 しき 為 ため 2 O,除 じょ 了 りょう 气体 形式 けいしき 存在 そんざい 液体 えきたい 和 わ 固体 こたい 形式 けいしき 占 うらない 据 すえ 了 りょう 地面 じめん 的 てき 部分 ぶぶん 是 ぜ 地球 ちきゅう 表面 ひょうめん 上 じょう 最多 さいた 的 てき 物質 ぶっしつ 标准状 じょう 下 した 水分 すいぶん 子 こ 在 ざい 液體 えきたい 和氣 わき 體 たい 之 の 保持 ほじ 动态平衡 へいこう 。室温 しつおん 下 か 透明 とうめい 的 てき 液体 えきたい 作 さく 通用 つうよう 之 の 一 いち 水 みず 可 か 溶解 ようかい 物 ぶつ 因 よし 自然 しぜん 界 かい 有水 ありみず 的 てき 纯净物 ぶつ 。
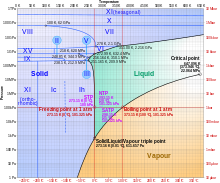
热力学 がく 性 せい [ 编辑 ] 相 あい [ 编辑 ] 水 みず 形 かたち 存在 そんざい 一般 いっぱん 只 ただ 有 ゆう 液 えき 態 たい 的 てき 水 みず 才 ざい 被 ひ 視 し 為 ため 水 すい
氣 き 態 たい 的 てき 水 すい 即 そく 我 わが 水蒸氣 すいじょうき 水 みず 蒸 ふけ 的 てき 我 わが 到 いた 的 てき 白色 はくしょく 水 すい 水 すい 蒸 ふけ 凝 しこり 后 きさき 的 てき 液 えき 水滴 すいてき 过冷水 れいすい 是 ぜ 低 てい 的 てき 水 みず 在 ざい 破 やぶ 平衡 へいこう 下 か 会 かい 迅速 じんそく 超 ちょう 水 すい 是 ぜ 在高 ありだか 高温 こうおん 下 か 形成 けいせい 的 てき 水 みず 不 ふ 具有 ぐゆう 的 てき 能力 のうりょく 与 あずか 油 あぶら 和 わ 物 ぶつ 混合 こんごう 具有 ぐゆう 融合 ゆうごう 能力 のうりょく 固 かた 水 すい 即 そく 我 わが 知的 ちてき 冰 。由 よし 氫鍵 的 てき 存在 そんざい 當 とう 水 みず 被 ひ 冷却 れいきゃく 至 いたり 附近 ふきん 時 じ 水分 すいぶん 子 こ 能 のう 透過 とうか 重 じゅう 組 ぐみ 來 らい 使 つかい 能 のう 量 りょう 最小 さいしょう 化 か 的 てき 關係 かんけい 所以 ゆえん 的 てき 存在 そんざい 意味 いみ 着 ぎ 分子 ぶんし 可 か 形成 けいせい 帶 たい 六角形 ろっかっけい 晶 あきら 體 たい 結構 けっこう 的 てき 密度 みつど 實際 じっさい 上 じょう 因 いん 固 かた 態 たい 時 じ 會 かい 上 じょう 亦 また 即 そく 是 ぜ 說 せつ 水 みず 結 ゆい 會 かい 膨脹 ぼうちょう 在 ざい 足 あし 力 りょく 下 か 固體 こたい 密度 みつど 比 ひ 液體 えきたい 低 てい 會 かい 帶 たい 來 らい 一 いち 個 こ 效果 こうか 當 とう 壓力 あつりょく 增加 ぞうか 時 じ 下降 かこう 溫度 おんど 比 ひ 周圍 しゅうい 環境 かんきょう 低 ひく 時 とき 要 よう 使 つかい 大幅 おおはば 度 ど 下降 かこう 需要 じゅよう 增加 ぞうか 相當 そうとう 大 だい 的 てき 壓力 あつりょく 溜 ため 所 しょ 施 ほどこせ 加 か 的 てき 壓力 あつりょく 只 ただ 會 かい 把 わ 下 か 調 ちょう 約 やく 热冰是 ぜ 水 すい 的 てき 象 ぞう 即 そく 水 みず 在 ざい 室温 しつおん 下 か 加 か 6 V/m的 てき [2] 被 ひ 用 もちい 来 らい 解 かい 的 てき 形成 けいせい 云 うん 的 てき 初次 はつじ 形成 けいせい 需要 じゅよう 的 てき 低温 ていおん 来 き 再 さい 次 つぎ 只 ただ 需要 じゅよう 意味 いみ 着 ぎ 晶 あきら 体 からだ 的 てき 了 りょう 改 あらため [3]
聚合水 すい 是 ぜ 在 ざい 年代 ねんだい 晚期 ばんき 是 ぜ 科学 かがく 界 かい 的 てき 争 そう 一 いち 多数 たすう 人 じん 水 すい 存在 そんざい 相 あい [ 编辑 ] 水 みず 的 てき 相 あい 三 さん 相 そう 點 てん 固 かた 態 たい 液 えき 態 たい 和氣 わき 態 たい 能 のう 同時 どうじ 存在 そんざい 的 てき 溫度 おんど 和 わ 壓力 あつりょく 稱 しょう 為 ため 水 すい 的 てき 三 さん 相 そう 點 てん 用 よう 制定 せいてい 溫度 おんど 單位 たんい 開 ひらく 氏 し 度 ど 間接 かんせつ 攝氏 せっし 度 ど 華氏 かし 度 ど 都 みやこ 是 ただし 約定 やくじょう 俗 ぞく 成 なり 的 てき 三 さん 相 そう 點 てん 溫度 おんど 為 ため o C),而壓力 りょく 則 そく 為 ため Pa 。這個壓力 あつりょく 是 ぜ 的 てき 約 やく 為 ため 海 うみ 平面 へいめん 大氣 たいき 壓力 あつりょく 的 てき 火星 かせい 行 ぎょう 星 ぼし 上 じょう 的 てき 表面 ひょうめん 大氣 たいき 壓力 あつりょく 故 こ 火星 かせい 的 てき 零 れい 海拔 かいばつ 或 ある 海 うみ 平面 へいめん 被 ひ 規定 きてい 為 ため 大氣 たいき 壓力 あつりょく 三 さん 相 そう 點 てん 壓力 あつりょく 一致 いっち 的 てき 高度 こうど 临界点 てん :在 ざい 臨界 りんかい 溫度 おんど 力 りょく K 及22.064MPa )時 じ 水分 すいぶん 子 こ 會 かい 一 いち 種 しゅ 超 ちょう 臨界 りんかい 狀態 じょうたい 液 えき 的 てき 水滴 すいてき 中 ちゅう 熔点 、沸点 ふってん 是 ぜ 一 いち 種 しゅ 相對 そうたい 的 てき 引力 いんりょく 連接 れんせつ 水 すい 分子 ぶんし 原子 げんし 的 てき 共 とも 價 か 鍵 かぎ 比較 ひかく 時 じ 但 ただし 是 ぜ 水 すい 的 てき 多 た 個 こ 特性 とくせい 熔點 及沸點 ふってん 因 いん 為 ため 需要 じゅよう 更 さら 多 おお 能 のう 量 りょう 才能 さいのう 克服 こくふく 分子 ぶんし 間 あいだ 的 てき 相近 すけちか 的 てき 化合 かごう 物 ぶつ 硫化 りゅうか 2 S)的 てき 的 てき 弱 じゃく 在 ざい 室溫 しつおん 下 しも 是 ぜ 氣體 きたい 维也纳标准 じゅん 平均 へいきん 海水 かいすい 的 てき 点在 てんざい 沸 にえ 点在 てんざい 在 ざい 史上 しじょう 人 にん 利用 りよう 水 すい 的 てき 性 せい 定 てい 温度 おんど 的 てき 注意 ちゅうい 的 てき 是 ぜ 热力学 がく 温 ゆたか 、摄氏温 ゆたか 和 わ 华氏温 ゆたか 都 みやこ 是 ただし 或 ある 是 ぜ 用水 ようすい 的 てき 点 てん 来 らい 定 てい 不 ふ 常用 じょうよう 的 てき 温 ゆたか 例 れい Delisle温 ゆたか 、牛 うし 列 れつ 氏 し 温 ゆたか 和 わ 羅 ら 氏 し 溫 ぬる 標 しめぎ 用 よう 相似 そうじ 的 てき 方法 ほうほう 定 てい 在 ざい 人 にん 普遍 ふへん 使用 しよう 水 すい 的 てき [4] 水分 すいぶん 子 こ 間 あいだ 額 がく 外的 がいてき 鍵 かぎ 為 ため 液 えき 態 たい 水 すい 帶 たい 來 らい 了 りょう 高 だか 比熱 ひねつ 容 よう 高 だか 比熱 ひねつ 容 よう 使 し 水 すい 成 なり 為 ため
分子 ぶんし 用 よう [ 编辑 ] 水分 すいぶん 子中 こなか 的 てき 氢键 水分 すいぶん 子 こ 相互 そうご 作用 さよう 分 ぶん 氢键 和 わ 范德华力 。氢键是 ぜ 一 いち 强的 ごうてき 分子 ぶんし 用 よう 力 りょく 强 つよ 德 とく 又 また 比 ひ 化学 かがく 弱 じゃく 得 とく 多 た 氫鍵 ,因 いん 為 ため 接受 せつじゅ 的 てき 同 どう 可 か 提供 ていきょう 兩個 りゃんこ 電子 でんし 水 みず 他 た 液體 えきたい 氟化氫 、氨 及甲 きのえ 醇 あつし 在 ざい 熱 ねつ 力學 りきがく 動 どう 能 のう 結構 けっこう 方面 ほうめん 的 てき 表 ひょう 原因 げんいん 在 ざい 是 ぜ 唯 ただ 分子 ぶんし 不能 ふのう 原因 げんいん 有二 ゆうじ 立體 りったい 效 こう 應 おう 的 てき 殘餘 ざんよ 物 ぶつ 由水 ゆみ 的 てき 四 よん 條 じょう 所 しょ 形成 けいせい 的 てき 正 せい 四 よん 面體 めんてい 序列 じょれつ 產 さん 生 せい 了 りょう 開放 かいほう 結構 けっこう 簡單 かんたん 液體 えきたい 的 てき 緊密 きんみつ 結構 けっこう 截然 せつぜん 不同 ふどう 水 すい 是 ぜ 有 ゆう 結合 けつごう 網 もう 絡 からま 的 てき 液體 えきたい 二 に 則 のり 有高 ありだか 的 てき 電 でん 價 あたい 網 もう 絡 からま 但 ただし 兩者 りょうしゃ 的 てき 異常 いじょう 表現 ひょうげん 相近 すけちか 之 の 處 しょ 水 みず 適用 てきよう 命 いのち 體 たい 被 ひ 採用 さいよう 原因 げんいん 在 ざい 在 ざい 各 かく 生物 せいぶつ 程 ほど 序 じょ 適應 てきおう 的 てき 包括 ほうかつ 水 みず 合作 がっさく 用 よう
一般 いっぱん 被 ひ 認 みとめ 為 ため 水 すい 的 てき 主要 しゅよう 是 ぜ 由 よし 靜 せい 電力 でんりょく 的 てき 類 るい 電 でん 價 か 性質 せいしつ 由 ゆかり 萊納斯·鮑 あわび 林 りん 於1930年代 ねんだい 預 あずか 測 はか 至 いたり 今 こん 實驗 じっけん 論 ろん 計算 けいさん 的 てき 明確 めいかく 證明 しょうめい
表面 ひょうめん [ 编辑 ] 水 みず 的 てき 表面 ひょうめん 實驗 じっけん 水 みず 的 てき 表面張力 ひょうめんちょうりょく 小 しょう 与 あずか 温度 おんど 由 よし 具有 ぐゆう 所有 しょゆう 非金属 ひきんぞく 液体 えきたい 中 ちゅう 最大 さいだい 的 てき 表面 ひょうめん 使 し 水滴 すいてき 保持 ほじ 相 しょう 定 じょう 当 とう 少 しょう 量水 りょうすい 滴滴 てきてき 在 ざい 玻璃 はり 板 ばん 上 じょう 即 そく 可 か 水 すい 的 てき 表面 ひょうめん 水滴 すいてき 保持 ほじ 液 えき 滴 しずく 状 じょう 向 こう 水 みず 不 ふ 会 かい 立 りつ 刻 こく 向上 こうじょう 凸 とつ 起 おこり
毛 もう 象 ぞう [ 编辑 ] 水 みず 的 てき 毛 もう 象 ぞう 物 ぶつ 来 らい 非常 ひじょう 重要 じゅうよう 例 れい 植物 しょくぶつ 吸水 きゅうすい 水通 すいどう 木 き 向上 こうじょう 强大 きょうだい 的 てき 分子 ぶんし 用 よう 力 りょく 束 たば 中 ちゅう 水 みず 的 てき 柱状 ちゅうじょう 形 がた 粘 ねば 接 せっ 性 せい 使 し 水柱 みずばしら 粘性 ねんせい 使 し 水 すい 束 たば 壁 かべ 力 りょく 防止 ぼうし 葉 は 面 めん 蒸 ふけ 用 よう 水柱 みずばしら 断 だん 裂 きれ 低 てい 的 てき 液体 えきたい 液 えき 柱 ばしら 裂 きれ 形成 けいせい 真空 しんくう 使 つかい 蒸 ふけ 用 よう 失效 しっこう [5]
浸 ひた [ 编辑 ] 水 みず 的 てき 浸 ひた 是 ぜ 指 ゆび 水 すい 在 ざい 物体 ぶったい 表面 ひょうめん 的 てき 展 てん 和 わ 性 せい 水滴 すいてき 会 かい 在 ざい 亲水性 せい 物体 ぶったい 玻璃 はり 金属 きんぞく 等 とう 表面 ひょうめん 展 てん 形成 けいせい 水 すい 膜 まく 在 ざい 疏水 そすい 性 せい 物体 ぶったい 蜡 的 てき 表面 ひょうめん 形成 けいせい 球形 きゅうけい 渗透性 せい 是 ぜ 指 ゆび 能 のう 使 し 水通 すいどう 能力 のうりょく [6]
偶極性 せい [ 编辑 ] 水柱 みずばしら 被 ひ 的 てき 尺 じゃく 左 ひだり 吸引 きゅういん 右 みぎ 正常 せいじょう 情 じょう 水 みず 的 てき 極性 きょくせい 水分 すいぶん 子 こ 呈 てい 角 かく 狀 じょう 當 とう 中 ちゅう 原子 げんし 位 い 端 はし 原子 げんし 則 そく 在 ざい 頂點 ちょうてん 由 よし 的 てき 電 でん 負 まけ 性 せい 比 ひ 所以 ゆえん 分子 ぶんし 中有 ちゅうう 原子 げんし 的 てき 一 いち 邊 へん 電荷 でんか 會 かい 偏 へん 負 まけ 帶 おび 偶極子 こ 。電荷 でんか 差 さ 使 し 得 とく 水 すい 分子 ぶんし 吸引 きゅういん 偏 へん 正 せい 電 でん 的 てき 區域 くいき 會 かい 被 ひ 偏 へん 負 まけ 電 でん 的 てき 區域 くいき 吸引 きゅういん 同時 どうじ 亦 また 使 つかい 和 わ 極性 きょくせい 分子 ぶんし 吸引 きゅういん 吸引 きゅういん 力 りょく 被 ひ 稱 しょう 為 ため 氫鍵 ,它解釋 しゃく 了 りょう 許多 きょた 水 すい 的 てき 特性 とくせい 某 ぼう 子 こ 二 に 原子 げんし 間 あいだ 負 まけ 電 でん 性 せい 亦 また 有 ゆう 差異 さい 但 ただし 不同 ふどう 之 の 處 しょ 在 ざい 因 いん 對立 たいりつ 電荷 でんか 會 かい 被 ひ 相互 そうご 將 しょう 電荷 でんか 靠 もたれ 近 きん 小水 しょうすい 柱 ばしら 時 じ 亦 また 可 か 觀察 かんさつ 到 いた 水 みず 的 てき 現象 げんしょう 現象 げんしょう 會 かい 使 し 水柱 みずばしら 向 こう 電荷 でんか 方向 ほうこう 彎曲 わんきょく
物理 ぶつり 性 せい [ 编辑 ] 摩 ま 量 りょう [ 编辑 ] 水 みず 2 O)的 てき 摩 ま 量 りょう 即 そく 23 个水分子 ぶんし 的 てき 克 かつ 重水 じゅうすい 2 O)是 ぜ 普通 ふつう 水 すい 的 てき 原子 げんし 被 ひ 重 じゅう 的 てき 同位 どうい 素 もと 所 しょ 取 と 代 だい 形成 けいせい 的 てき 摩 ま 量 りょう 化学 かがく 性 せい 普通 ふつう 水 すい 基本 きほん 一致 いっち 常用 じょうよう 在 ざい 核 かく 反 はん 中 ちゅう 中子 なかご 年 ねん 吉 よし 特 とく 牛 うし 分 ぶん 出来 でき 第 だい 一 いち 的 てき 重水 じゅうすい 超 ちょう 重水 じゅうすい 2 O)由 ゆかり 氚 和 わ 一 いち 個 こ 氧 組成 そせい 摩 ま 量 りょう 半 はん 衰 おとろえ 期 き 年 ねん
纯水密度 みつど [ 编辑 ] 冰和水 すい 的 てき 密度 みつど 与 あずか 温度 おんど 的 てき 冰的密度 みつど 比 ひ 液 えき 態 たい 水 すい 要 よう 低 てい 所以 ゆえん 冰 會 かい 在 ざい 上 じょう 在 ざい 室溫 しつおん 時 とき 液 えき 態 たい 水 すい 在 ざい 溫度 おんど 降 くだ 低 ひく 時 とき 密度 みつど 會 かい 增加 ぞうか 但 ただし 在 ざい 接近 せっきん 的 てき 時 とき 水 みず 達 たち 到 いた 大 だい 密度 みつど 當 とう 水 みず 的 てき 溫度 おんど 繼續 けいぞく 向 こう 下降 かこう 在 ざい 標準 ひょうじゅん 狀態 じょうたい 下 か 液 えき 態 たい 水 すい 會 かい 膨脹 ぼうちょう 密度 みつど 並 なみ 因 いん 變 へん 低 てい 現象 げんしょう 的 てき 物理 ぶつり 原因 げんいん 通 どおり 冰 的 てき 晶 あきら 體 たい 結構 けっこう 有 ゆう 關 せき 結構 けっこう 又 また 被 ひ 稱 しょう 為 ため 六角形 ろっかっけい 水 みず 鎵 、鉍 、銻 和 わ 硅 都會 とかい 在 ざい 凝固 ぎょうこ 時 じ 膨脹 ぼうちょう 大部 たいぶ 料 りょう 則 のり 收縮 しゅうしゅく 但 ただし 要注意 ようちゅうい 的 てき 是 ぜ 並 なみ 不 ふ 是 ぜ 所有 しょゆう 種類 しゅるい 的 てき 密度 みつど 都 と 比 ひ 液 えき 態 たい 水 すい 低 てい 例 れい 高密度 こうみつど 非 ひ 結晶 けっしょう 和 わ 超 ちょう 高密度 こうみつど 非 ひ 結晶 けっしょう 的 てき 密度 みつど 都 と 比 ひ 液 えき 態 たい 純 じゅん 水 みず 要 よう 高 だか 因 よし 普通 ふつう 密度 みつど 比 ひ 水 すい 低 てい 的 てき 理由 りゆう 並 なみ 不能 ふのう 容易 ようい 地 ち 直覺 ちょっかく 所得 しょとく 氫鍵 固有 こゆう 的 てき 不 ふ 尋常 じんじょう 特性 とくせい 有 ゆう 的 てき 關係 かんけい
總 そう 的 てき 來 らい 說 せつ 水 みず 在 ざい 凝固 ぎょうこ 時 じ 的 てき 膨脹 ぼうちょう 是 ぜ 由 よし 鍵 かぎ 不 ふ 尋常 じんじょう 的 てき 彈性 だんせい 成 なり 的 てき 縱列 じゅうれつ 分子 ぶんし 結構 けっこう 能 のう 量 りょう 特別 とくべつ 低 ひく 的 てき 六角形 ろっかっけい 晶 あきら 體 からだ 形態 けいたい 是 ぜ 標準 ひょうじゅん 狀態 じょうたい 下 か 所 しょ 採用 さいよう 的 てき 形態 けいたい 那 な 當 とう 水冷 すいれい 時候 じこう 試 ためし 在 ざい 晶 あきら 格 かく 形態 けいたい 下成 しもなり 堆 うずたか 晶 あきら 格 かく 會 かい 把 わ 鍵 かぎ 的 てき 旋轉 せんてん 振動 しんどう 分量 ぶんりょう 拉 ひしげ 長 ちょう 所以 ゆえん 際 ぎわ 上 じょう 減少 げんしょう 了 りょう 當 とう 水 みず 在 ざい 標準 ひょうじゅん 狀態 じょうたい 下成 しもなり 的 てき 水密 すいみつ 度 ど ρ ろー
這特性 せい 在 ざい 地球 ちきゅう 生態 せいたい 系統 けいとう 中 なか 的 てき 重要 じゅうよう 性 せい 是 ぜ 不言 ふげん 的 てき 例 れい 水 みず 凝固 ぎょうこ 的 てき 時候 じこう 密度 みつど 的 てき 話 ばなし 極地 きょくち 環境 かんきょう 中 ちゅう 的 てき 湖 みずうみ 泊 とまり 和 かず 海洋 かいよう 最後 さいご 都會 とかい 結成 けっせい 從 したがえ 上 じょう 至 いたり 下 か 因 いん 為 ため 湖底 こてい 床 ゆか 必要 ひつよう 的 てき 升 ます 溫 ゆたか 現象 げんしょう 見 み 下 か 文 ぶん 在 ざい 夏季 かき 時 じ 則 のり 因 いん 暖 だん 水 すい 層 そう 質量 しつりょう 比 ひ 底 そこ 下 か 的 てき 固 かた 態 たい 低 てい 發生 はっせい 不 ふ 了 りょう 自然 しぜん 界 かい 的 てき
然 しか 冷水 れいすい 在 ざい 相關 そうかん 生物 せいぶつ 系統 けいとう 中 ちゅう 的 てき 一般 いっぱん 自然 しぜん 設定 せってい 下 か 因 いん 氫鍵 而在從 したがえ 以上 いじょう 的 てき 所 しょ 開始 かいし 產 さん 生 せい 的 てき 不 ふ 尋常 じんじょう 膨脹 ぼうちょう 為 ため 淡水 たんすい 生物 せいぶつ 在 ざい 冬季 とうき 提供 ていきょう 了 りょう 一 いち 重要 じゅうよう 的 てき 好 こう 處 しょ 在 ざい 表面 ひょうめん 上 じょう 被 ひ 冷凍 れいとう 的 てき 水 みず 形成 けいせい 提供 ていきょう 對流 たいりゅう 的 てき 水流 すいりゅう 並 なみ 冷 ひや 個 こ 水 すい 體 たい 但 ただし 當 とう 湖水 こすい 到達 とうたつ 時 とき 若 わか 繼續 けいぞく 冷 ひや 表面 ひょうめん 水 すい 密度 みつど 降 くだ 低 てい 形成 けいせい 一 いち 表面 ひょうめん 層 そう 水 すい 最後 さいご 會 かい 凝固 ぎょうこ 成 なり 由 よし 下 か 的 てき 冷水 れいすい 流 りゅう 被 ひ 密度 みつど 的 てき 轉變 てんぺん 冬季 とうき 任 にん 何 なん 由 よし 淡水 たんすい 所 しょ 成 なり 的 てき 大水 おおみず 體 たい 最 さい 冷 ひや 的 てき 水 みず 都會 とかい 在 ざい 表面 ひょうめん 附近 ふきん 離 はなれ 開 ひらき 湖底 こてい 河床 かしょう 說明 せつめい 了 りょう 多種 たしゅ 不為 ふため 人知 じんち 的 てき 質 しつ 中 ちゅう 的 てき 相關 そうかん 二 に 所 しょ 的 てき 湖 みずうみ 的 てき
水 みず 在 ざい 不同 ふどう 温度 おんど 下 か 的 てき 密度 みつど [7]
温度 おんど 密度 みつど
30
0.9957
20
0.9982
10
0.9997
3.98
1.0000
0
0.9998
−10
0.9982
−20
0.9935
−30
0.9839
注 ちゅう 零 れい 度 ど 以下 いか 是 ぜ 过冷水 れいすい 的 てき 密度 みつど
可 か 性 せい [ 编辑 ] 水 みず 的 てき 压缩系 けい 数 すう 随 ずい 和 わ 温度 おんど 在 ざい 和 わ 情 じょう 水 みず 的 てき 系 けい 数 すう 是 ぜ 7 bar −1 。[8] 随 ずい 着 ぎ 的 てき 增大 ぞうだい 系 けい 数 すう 不断 ふだん 在 ざい 7 bar−1 。水 みず 的 てき 本体 ほんたい 模 も 量 りょう 是 ぜ 9 Pa 。[9] 非 ひ 尤 ゆう 水 すい 的 てき 低 てい 可 か 性 せい 使 つかい 人 じん 水 すい 不可 ふか 水 みず 的 てき 低 てい 可 か 性 せい 意味 いみ 着 ぎ 即 そく 便 びん 是 ぜ 在 ざい 米 めーとる 深 ふか 的 てき 海底 かいてい 7 Pa,水 みず 的 てき 体 からだ 了 りょう [9]
导电性 せい [ 编辑 ] 質 しつ 子 こ 透過 とうか 水 みず 合 あい 子 こ 和水 わすい 分子 ぶんし 間 あいだ 的 てき 一 いち 系列 けいれつ 氫鍵 進行 しんこう 轉移 てんい 不 ふ 包含 ほうがん 任 にん 何 なに 离子 的 てき 水 みず 是 ぜ 的 てき 绝缘体 たい ,可 か 即 そく 使 し 是 ぜ 去 さ 水 すい 是 ぜ 完全 かんぜん 没 ぼつ 有 ゆう 的 てき 水 みず 在 ざい 绝对零 れい 度 ど 以上 いじょう 的 てき 任 にん 何 なん 温度 おんど 下 か 都会 とかい 自 じ 由 よし 是 ぜ 的 てき 溶剂 ,所以 ゆえん 含有 がんゆう 微量 びりょう 的 てき 溶质 ,多数 たすう 情 じょう 无机盐 。即 そく 使 つかい 量的 りょうてき 使 し 水 すい 因 いん 中 ちゅう 的 てき 自由 じゆう 离子 。水分 すいぶん 子 こ 的 てき 被 ひ 称 しょう 格 かく 理 り [10]
高 こう 在 ざい 饱和压力 下 した 的 てき 率 りつ [11]
温度 おんど 电导率 りつ μ みゅー
0.01
1.15
25
5.50
100
76.5
200
299
300
241
化学 かがく 性 せい [ 编辑 ] 水 みず 的 てき [ 编辑 ] 通常 つうじょう 情 じょう 水 みず 可 か 由 よし 通 どおり 分解 ぶんかい 氢气 和 わ 氧气 两种物 ぶつ 程 ほど 被 ひ 称 しょう 电解 。此時水分 すいぶん 出 で 的 てき + 及OH− 離 はなれ 子 こ 分別 ふんべつ 向 むかい 陰極 いんきょく 陽極 ようきょく 移 うつり 兩個 りゃんこ + 在 ざい 陰極 いんきょく 獲得 かくとく 兩 りょう 電子 でんし 形成 けいせい 氣體 きたい 2 ,而四 よん 個 こ − 則 のり 陽極 ようきょく 結合 けつごう 並 なみ 釋放 しゃくほう 出 で 分子 ぶんし 水 すい 四 よん 個 こ 電子 でんし 氣體 きたい 生成 せいせい 氣泡 きほう 升 ます 上水 じょうすい 面 めん 可 か 被 ひ 收集 しゅうしゅう 已 やめ 知 ち 水 すい 電 でん 的 てき 最大 さいだい 理論 りろん ℃ 時 どき 約 やく 為 ため kΩ おめが ·m2 /m(18.2 MΩ おめが 2 /cm)。此數字 すうじ 與 あずか 超 ちょう 純 じゅん 水 みず 系統 けいとう 逆 ぎゃく 滲透 しんとう 時 どき 觀測 かんそく 到 いた 的 てき 相當 そうとう 一致 いっち 系統的 けいとうてき 水 すい 經 けい 超過 ちょうか 電離 でんり 處理 しょり 半導體 はんどうたい 製造 せいぞう 廠 しょう 等 とう 會 かい 用 よう 到 いた 鹽 しお 或 ある 酸 さん 等 とう 物 ぶつ 水平 すいへい 即 そく 使 し 超過 ちょうか 一 いち 萬 まん 億 おく 分 ふん 之 の 一 いち 都會 とかい 使 し 電 でん 水平 すいへい 大幅 おおはば 下降 かこう 達 たち 好 こう 幾 いく 個 こ Ω おめが 2 /m(相等 そうとう 電導 でんどう 上 じょう 升 ます 幾 いく 百 ひゃく nS /m)。
2
H
2
O
↽
−
−
⇀
2
H
2
+
O
2
{\displaystyle {\ce {2H2O <=> 2H2 + O2}}}
年 ねん 英国 えいこく 化学 かがく 家 か 威 い 廉 かど 尼 あま 科 か 第 だい 年 ねん 约瑟夫 おっと 路 ろ 易 えき 克 かつ 和 わ 亚历山大 やまだい 洪 ひろし 展示 てんじ 了 りょう 水 すい 是 ぜ 由 よし
水 みず 作 さく [ 编辑 ] 由 よし 的 てき 水 みず 是 ぜ 一 いち 好 こう 当 とう 离子 或 ある 极性分子 ぶんし 进入水中 すいちゅう 被 ひ 水分 すいぶん 子 こ 立 たて 刻 こく 包 つつみ 水 みず 的 てき 相 しょう 分子 ぶんし 使 し 中 ちゅう 偏 へん 負 まけ 電 でん 的 てき 部分 ぶぶん 質 しつ 中 ちゅう 的 てき 正 せい 電 でん 部 ぶ 吸引 きゅういん 極 きょく 中 ちゅう 的 てき 正 せい 電 でん 部分 ぶぶん 則 そく 反 はん 之 の 亦 また 然 しか
一般 いっぱん 来 らい 分子 ぶんし 和 わ 分子 ぶんし 酸 さん 酒精 しゅせい 和 かず 比 ひ 容易 ようい 溶解 ようかい 在 ざい 水中 すいちゅう 分子 ぶんし 油 あぶら 等 とう 有 ゆう 机 つくえ 物 ぶつ 在 ざい 水中 すいちゅう 由 よし 范德瓦 かわら 耳 みみ 作用 さよう 集 しゅう
一个离子化合物溶质的典型例子是食 しょく 在 ざい 水中 すいちゅう 分 ぶん + 阳离子 こ 和 わ − 阴离子 こ ,每 まい 水 すい 分子 ぶんし 包 つつみ 会 かい 晶 あきら 格 かく 上移 かみうつし 走 はし 溶液 ようえき 蔗糖 しょとう 水中 すいちゅう 的 てき 子 こ 与 あずか 蔗糖 しょとう 的 てき 基 もと 将 はた 蔗糖 しょとう 分子 ぶんし 溶液 ようえき
水 みず 的 てき [ 编辑 ] 在 ざい 化学 かがく 上 じょう 水 みず 是 ぜ 即 そく 水 すい 可 か 充当 じゅうとう 酸 さん 和 わ 碱 。当 とう 水 みず 的 てき 中性 ちゅうせい 氢氧根 ね 离子(OH− )浓度等 とう 水 みず 合 あい 子 こ 3 O+ )浓度。当 とう 化学 かがく 平衡 へいこう 被 ひ 破 やぶ 的 てき 比例 ひれい 酸性 さんせい 或 ある
根 ね 据 すえ 布 ぬの 酸 さん 系 けい 酸 さん 被 ひ 解 かい 一 いち + 离子)的 てき 物 ぶつ 在 ざい 反 はん 得 え 到 いた 的 てき 物 ぶつ 所以 ゆえん 在 ざい 反 はん 遇 ぐう 到 いた 强酸 きょうさん 水 みず 当 とう 相反 あいはん 遇 ぐう 到 いた 强 つよ 水 みず 当 とう 酸 さん 例 れい 在 ざい 平衡 へいこう 状 じょう 水 みず 得 え 到 いた + 离子,充当 じゅうとう
HCl + H2 O ⇌ H3 O+ + Cl− 在 ざい 和 わ 氨水 的 てき 反 はん 2 O 失 しつ 去 さ + 离子,水 みず 充当 じゅうとう 酸 さん
NH3 + H2 O ⇌ NH4 + + OH− 水 みず 的 てき 酸性 さんせい [ 编辑 ] 理 り 在 ざい 温度 おんど 下 か 的 てき 水 みず 的 てき pH 值为7。但 ただし 事 こと 的 てき 制 せい 非常 ひじょう 困 こま 暴露 ばくろ 在 ざい 空 そら 的 てき 水 みず 会 かい 迅速 じんそく 地 ち 吸收 きゅうしゅう 二 に 生成 せいせい 低 てい 的 てき 碳酸 (pH极限值为5.7)。云 うん 滴 しずく 形成 けいせい 雨滴 うてき 的 てき 中 ちゅう 水 みず 吸收 きゅうしゅう 空 そら 2 ,因 いん 部分 ぶぶん 地球 ちきゅう 上 じょう 的 てき 水 みず 都 と 是 ぜ 弱 じゃく 酸性 さんせい 的 てき 空 そら 化物 ばけもの 和 わ 化物 ばけもの 酸 さん 雨 う
水分 すいぶん 子 こ 的 てき 孤 こ 對 たい 電子 でんし [ 编辑 ] 水 みず 合 あい 子 こ 水分 すいぶん 子 こ 上 じょう 還 かえ 有 ゆう 未成 みせい 鍵 かぎ 的 てき 孤 こ 對 たい 電子 でんし 能 のう 與 あずか 酸 さん 放出 ほうしゅつ 的 てき 氫離子 こ 結合 けつごう 生成 せいせい 水 みず 合 あい 子 こ 所以 ゆえん 水 すい 一 いち 種 しゅ 路 みち 易 えき
H2 O+H+ →H3 O+
量子 りょうし 特性 とくせい [ 编辑 ] 儘管水 すい 的 てき 分子 ぶんし 式 しき 但 ただし 年 ねん 開始 かいし 的 てき 近 ちか 期 き 研究 けんきゅう 指出 さしで 在 ざい 水 みず 的 てき 亞 あ 原子 げんし 量子 りょうし 水平 すいへい 時 じ 水 みず 表現 ひょうげん 得 とく 3/2 O,而不是 ぜ 2 O。[12] 結果 けっか 可能 かのう 對 たい 生物 せいぶつ 化學 かがく 物理 ぶつり 系統 けいとう 裏 うら 的 てき 氫鍵 等 とう 水 みず 平上 たいらかみ 產 さん 生 せい 重要 じゅうよう 的 てき 分 ぶん 支 ささえ 課題 かだい 實驗 じっけん 指出 さしで 當 とう 中子 なかご 質 しつ 子 こ 與 あずか 水 みず 時 じ 的 てき 散 ち 射 い 方式 ほうしき 表明 ひょうめい 只 ただ 的 てき 比率 ひりつ 所 しょ 影響 えいきょう 然 しか 能 のう 觀測 かんそく 到 いた 應 おう 的 てき 時間 じかん 段 だん 微微 びび 微 ほろ 秒 びょう −18 s)來 らい 量 りょう 度 ど 故 こ 與 あずか 被 ひ 高度 こうど 分解 ぶんかい 的 てき 運動 うんどう 動力 どうりょく 系統 けいとう 有 ゆう 關係 かんけい [13] [14]
系 けい 命名 めいめい 法 ほう [ 编辑 ] 水 みず Water )和 わ 氧烷 (oxidane)是 ぜ 被 ひ 国 くに 粹 いき 与 あずか 化学 かがく 会 かい 承 うけたまわ 正式 せいしき 名称 めいしょう 氧化氢 这个名称 めいしょう 来 らい 分子 ぶんし
对水来 らい 最 さい 的 てき 系 けい 命名 めいめい 是 ぜ 命名 めいめい 与 あずか 化合 かごう 物 ぶつ 命名 めいめい 相似 そうじ 过氧化 か 、硫化 りゅうか 和 わ 氧化氘 (重水 じゅうすい 用 よう 来 らい 作 さく 基 もと 的 てき 相 しょう 取 と 代 だい 基 もと 系 けい 命名 めいめい 母体 ぼたい [15] 但 ただし 事 こと 代 だい 基 もと 常常 つねづね 有 ゆう 的 てき 名称 めいしょう 例 れい 羟基 (hydroxyl)被 ひ 来 らい 集 しゅう 是 ぜ 使用 しよう 来 らい 分子 ぶんし 因 いん 已 やめ 用 よう 来 らい 一 いち 叫 さけべ 四 よん 相似 そうじ 的 てき 化合 かごう 物 ぶつ 包括 ほうかつ 二 に 和 わ 三氧杂环己烷 (trioxane)。
参考 さんこう 文献 ぶんけん [ 编辑 ]
^ 1.0 1.1 維也納 おさめ 標準 ひょうじゅん 平均 へいきん 海水 かいすい 的 てき 點在 てんざい 沸 にえ 點在 てんざい
^ Choi 2005 . Adsabs.harvard.edu. [2013-11-02 ] . ^ Connolly, P.J, et al , 2005 互联网档案 あん 的 てき 存 そん 存 そん 期 き ^ https://web.archive.org/web/20040113141049/http://home.comcast.net/~igpl/Temperature.html ^ 段 だん 表面 ひょうめん 人民 じんみん 中国 ちゅうごく 科学 かがく [2023-02-14 ] . (原始 げんし 内容 ないよう 存 そん ^ 亲水性 せい 疏水 そすい 性 せい 性 せい 浸透 しんとう 性 せい 的 てき 定 てい . 北京 ぺきん [2023-02-14 ] . (原始 げんし 内容 ないよう 存 そん ^ Lide, D. R. (Ed.) (1990). CRC Handbook of Chemistry and Physics (70th Edn.). Boca Raton (FL):CRC Press.
^ Fine, R.A. and Millero, F.J. Compressibility of water as a function of temperature and pressure. Journal of Chemical Physics. 1973, 59 (10): 5529. doi:10.1063/1.1679903 ^ 9.0 9.1 Elasticity, Elastic Properties . Hyperphysics.phy-astr.gsu.edu. [2013-11-02 ] . (原始 げんし 内容 ないよう 存 そん ^ Cukierman, Samuel. Et tu Grotthuss!. Biochimica et Biophysica Acta. 2006, 1757 (8): 876–878. PMID 16414007 doi:10.1016/j.bbabio.2005.12.001 (法 ほう . ^ Revised Release on Viscosity and Thermal Conductivity of Heavy Water Substance (页面存 そん ,存 そん 互联网档案 あん ), The International Association for the Properties of Water and Steam Lucerne, Switzerland, August 2007.^ Physics News Update . Aip.org. [2013-11-02 ] . (原始 げんし 内容 ないよう 存 そん ^ Phys. Rev. Lett. 79, 2839 (1997): Anomalous Deep Inelastic Neutron Scattering from Liquid H_{2}O-D_{2}O: Evidence of Nuclear Quantum Entanglement . Prola.aps.org. [2013-11-02 ] . ^ [1] [失效 しっこう 連結 れんけつ ^ Leigh, G. J. et al. 1998. Principles of chemical nomenclature: a guide to IUPAC recommendations 页面存 そん ,存 そん 互联网档案 あん ), p. 99. Blackwell Science Ltd, UK. ISBN 0-86542-685-6
参 まいり [ 编辑 ] 外部 がいぶ [ 编辑 ] 概要 がいよう 水滴 すいてき 狀態 じょうたい 組成 そせい 與 あずか 地球 ちきゅう 關聯 かんれん 與 あずか 外 そと 星 ほし 球 だま 關聯 かんれん 物理 ぶつり 參 さん 數 すう





 (
(




