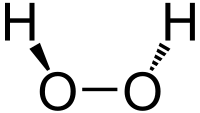
过氧化氢,分子式H₂O₂,是除水外的另一种氢的氧化物。比水稍黏,化学性质不稳定,一般以30%或60%的水溶液形式存放,其水溶液俗称双氧水。过氧化氢氧化力很强,且為弱酸。
性质[编辑]
纯过氧化氢是淡蓝粘稠液体,熔点−0.43 °C(272.72 K),沸点150.2 °C(423.3 K)。凝固点时固体密度每立方厘米1.71克,密度随温度升高而降低。其缔合度比水大,故介電係數和沸点比水高。纯过氧化氢甚稳定,但加热到153 °C(426 K)便猛烈分解为水和氧气。
过氧化氢可与水以任意比例互溶,可微弱电离,溶液呈弱酸性。
- H2O2 ↔ H++HO2- Ka1=2.4×10-12
- HO2- ↔ H++O22- Ka2≈10-25
过氧化氢与过量氢氧化钠反应生成過氧化鈉和水;与氢氧化钡反应生成过氧化钡。
过氧化氢分子为椅型结构,左图为气态时的结构,右图为固态晶体时的结构:


过氧化氢可溶于乙醇、乙醚,不溶于苯。对有机物有很强氧化作用,一般作为氧化剂使用。
催化劑[编辑]
生物体内過氧化氫酶(Catalase)可催化雙氧水分解,使其釋放出氧氣,转化为对有机体无毒的水:

二氧化錳、硫酸铜、碘化鉀和三氯化鐵等都能催化過氧化氫分解。
1818年,L.J.Thenard发现水系无机物、有机物在自动氧化时,或者在生物体内呼吸氧气时,在生成水之前会生成过氧化氢。
制备[编辑]
1950年代以前采用电解法制备过氧化氢,电解硫酸氢盐溶液(如硫酸氢铵、硫酸氢钾)得到过二硫酸盐[1],再加入硫酸[2]得到过氧化氢。
也有水解过硫酸铵或过氧化钠制取:


1953年,杜邦公司采用蒽醌法制备,以烷基蒽醌如2-乙基蒽醌为媒介,循环氧化还原製得。现在世界各国基本都使用此种技术。
目前,研究集中在基于氧的电化学还原和水的氧化的环保替代合成方法的开发上[3][4][5][6]。
反应[编辑]
过氧化氢是非常强的氧化剂,它和其他氧化剂的标准电极电势值列在右面,值越高代表氧化性越强:
分解[编辑]
过氧化氢可自发歧化分解生成水和氧气:

该反应在热力学自发:ΔHo为−98.2 kJ·mol−1,ΔGo为−119.2 kJ·mol−1,ΔS为70.5 J·mol−1·K−1。重金属离子Fe2+、Mn2+、Cu2+等可催化过氧化氢分解。它们在酸溶液中的电势介于过氧化氢的电势(0.694至1.76伏)之间,如Fe3+,认为过氧化氢把Fe3+还原为Fe2+,而本身氧化成氧气,过氧化氢又氧化产生的Fe2+为Fe3+,过氧化氢还原成水。过氧化氢在酸性和中性介质中甚稳定,在碱性介质易分解。过氧化氢用波长320至380nm的光照射会加速分解,应盛于棕色瓶并放在阴凉处。无水或浓缩过氧化氢必须在无尘、无金属杂质等環境处理,以防爆炸。H2O2与Fe2+的混合溶液称为芬顿试剂(Fenton)。Fe2+、Ti3+等的离子催化过氧化氢分解生成自由基中间体HO·(羟基自由基)和HOO·。一般使用的双氧水都会有一定量的稳定剂以减慢过氧化氢分解,常用稳定剂包括锡酸钠、焦磷酸钠、8-羟基喹啉和有机亚磷酸酯。[7]
氧化还原[编辑]
过氧化氢可在水溶液中氧化或还原很多无机离子,作还原剂时产物为氧,作氧化剂时产物为水;如酸性溶液中,过氧化氢可将Fe2+氧化为Fe3+:

过氧化氢可氧化亚硫酸根(SO2−
3)为硫酸根(SO2−
4)。高锰酸钾在酸性溶液会还原为Mn2+;标准电极电势顯示,反应在不同pH的方向可能不同,如碱性溶液中,过氧化氢会将錳II氧化为錳IV,以二氧化錳形式生成。
过氧化氢还原次氯酸钠的反应可用于实验室制备氧气:

有机化学常用过氧化氢作氧化剂,可将硫醚氧化为亚砜;將甲基苯基硫醚氧化为甲基苯基亚砜,以甲醇作溶剂或三氯化钛催化,产率为99%:

碱性过氧化氢溶液可用于环氧化富电子烯烃(如丙烯酸),以及在硼氢化-氧化反应第二步中氧化烷基硼至醇。
优点是氧化力强,还原产物为水,不引入杂质且不污染环境,是用途十分广泛的氧化剂。
生成过氧化物[编辑]
过氧化氢与很多无机或有机化合物反应时,过氧链保留并转移到另一分子,生成新的过氧化物:
- 4H2O2+Cr2O72-+2H+ → 2CrO5+5H2O
- 7H2O2+2CrO5+6H+ → 7O2↑+2Cr3++10H2O
- Na₂B₄O₇+4H₂O₂+2NaOH → 2Na₂B₂O₄(OH)₄+H₂O
与水相比,过氧化氢的碱性要弱得多,只有与很强的酸反应才会生成加合物。超强酸氟銻酸(HF/SbF5)可质子化过氧化氢,生成含[H3O2]+离子的产物。
用途[编辑]
稀(如3%)過氧化氫主要用於殺菌及外用的醫療用途,如消毒傷口。檢驗血液的最佳比率:6%雙氧水加0.005%亞甲藍。過氧化氫甚易化解,以界面活化劑等混合過氧化氫(稱為加速過氧化氫Accelerated Hydrogen Peroxide,簡稱AHP)﹐除加強殺菌消毒的效果,也可用作兼具殺菌效能的清潔劑。
較濃者(濃於10%),則用於紡織品、皮革、紙張、木材製造工業,作為漂白及去味劑。過氧化氫也是染髮劑的成份之一,还用作合成有机原料(邻苯二酚)的材料,医药、金属表面处理剂,聚合引发剂等。还可用作火箭推进剂。
很多颜料、涂料含有铅白。使用铅白的油画、壁画等艺术品长时间暴露在空气中,与硫化氢作用生成硫化铅而变暗发黑,用过氧化氢涂刷会生成白色的硫酸铅从而复原之。
- PbS+4H2O2 → PbSO4+4H2O
危險行為[编辑]
- 誤飲或以雙氧水灌肠,可侵蝕口腔或消化道黏膜而導致發炎,嚴重可穿孔或出血。
- 注射雙氧水將導致血栓,容易導致器官壞死,嚴重者可能會有生命危險。
- 一般食品加工禁止使用雙氧水。
历史事件[编辑]
- 1934年7月16日,德国使用火箭發動機的過氧化氫爆炸,炸死三人。
- 1939至1945年第二次世界大戰中,納粹德國在集中營中使用過氧化氫作為對人的致死試驗品。
- 2000年8月12日,库尔斯克号核潜艇鱼雷舱中的鱼雷在发射时由于内部过氧化氢燃料与催化剂接触,剧烈反应,导致爆炸,继而引起连锁反应,引爆了鱼雷舱中的所有鱼雷,彻底炸毁潜艇前部,潜艇最终沉没,全艇118人无人生还。
参见[编辑]
参考文献[编辑]
- ^ 电解:KHSO4 → K2S2O8+ H2↑
- ^ K2S2O8 + H2SO4 = K2SO4 + H2S2O8使过二硫酸水解,水解过程分为两步:H2S2O8 + H2O = H2SO5 + H2SO4;
H2SO5 + H2O = H2SO4 + H2O2
- ^ 存档副本. [2023-01-06]. (原始内容存档于2022-12-30).
- ^ 存档副本. [2023-01-06]. (原始内容存档于2023-01-05).
- ^ Perry, Samuel C.; Pangotra, Dhananjai; Vieira, Luciana; Csepei, Lénárd-István; Sieber, Volker; Wang, Ling; Ponce de León, Carlos; Walsh, Frank C. Electrochemical synthesis of hydrogen peroxide from water and oxygen. Nature Reviews Chemistry. 2019-07, 3 (7): 442–458 [2019-12-18]. ISSN 2397-3358. doi:10.1038/s41570-019-0110-6. (原始内容存档于2020-06-13) (英语).
- ^ Gyenge, E.L.; Oloman, C.W. Electrosynthesis of hydrogen peroxide in acidic solutions by mediated oxygen reduction in a three-phase (aqueous/organic/gaseous) system Part I: Emulsion structure, electrode kinetics and batch electrolysis. Journal of Applied Electrochemistry. 2003-08-01, 33 (8): 655–663 [2019-12-18]. ISSN 1572-8838. doi:10.1023/A:1025082709953. (原始内容存档于2022-05-12) (英语).
- ^ Hydrogen Peroxide Technical Library | USP Technologies. www.h2o2.com. [2021-01-07]. (原始内容存档于2021-04-26).