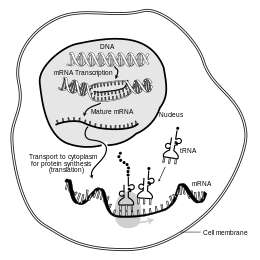
真 ま 核 かく 細胞 さいぼう mRNA のライフサイクルを示 しめ 模 も 式 しき 図 ず 細胞 さいぼう 核 かく 内 うち DNA から転写 てんしゃ 作 つく 次 つぎ 転写 てんしゃ 後 ご 修飾 しゅうしょく 行 おこな 細胞 さいぼう 質 しつ 輸送 ゆそう 後 ご リボソーム やtRNA と相互 そうご 作用 さよう 翻訳 ほんやく タンパク質 たんぱくしつ ペプチド )分子 ぶんし 作 つく 最終 さいしゅう 的 てき 分解 ぶんかい 分子生物学 ぶんしせいぶつがく 伝令 でんれい 英 えい messenger ribonucleic acid )は、mRNA またはメッセンジャーリボ核酸 かくさん とも呼 よ タンパク質 たんぱくしつ 合成 ごうせい 過程 かてい リボソーム によって読 よ 取 と 遺伝子 いでんし 遺伝子 いでんし 配列 はいれつ 対応 たいおう 一本 いっぽん 鎖 くさり リボ核酸 かくさん (RNA)分子 ぶんし
mRNAは、RNAポリメラーゼ という酵素 こうそ 遺伝子 いでんし 一 いち 次 じ 転写 てんしゃ 産物 さんぶつ mRNA前駆 ぜんく 体 たい (pre-mRNA)に変換 へんかん 転写 てんしゃ 過程 かてい 作 つく 通常 つうじょう 最終 さいしゅう 的 てき アミノ酸 あみのさん 配列 はいれつ コード しないイントロン という領域 りょういき 含 ふく RNAスプライシング の過程 かてい 除去 じょきょ タンパク質 たんぱくしつ 領域 りょういき エクソン のみが残 のこ 配列 はいれつ 成熟 せいじゅく 構成 こうせい 次 つぎ 成熟 せいじゅく 読 よ 取 と 転移 てんい 運 はこ アミノ酸 あみのさん 利用 りよう タンパク質 たんぱくしつ 作 つく 出 だ 過程 かてい 翻訳 ほんやく 知 し 過程 かてい 生物 せいぶつ 系 けい (英語 えいご 版 ばん 遺伝 いでん 情報 じょうほう 流 なが 説明 せつめい 分子生物学 ぶんしせいぶつがく セントラルドグマ の一部 いちぶ 形成 けいせい
mRNAの遺伝 いでん 情報 じょうほう デオキシリボ核酸 かくさん (DNA)と同様 どうよう ヌクレオチド 配列 はいれつ 含 ふく 連 れん リボヌクレオチド からなるコドン に配列 はいれつ 各 かく 特定 とくてい アミノ酸 あみのさん タンパク質 たんぱくしつ 合成 ごうせい 停止 ていし 終止 しゅうし 例外 れいがい アミノ酸 あみのさん 翻訳 ほんやく 認識 にんしき 対応 たいおう アミノ酸 あみのさん 供給 きょうきゅう 転移 てんい 含 ふく タンパク質 たんぱくしつ 製造 せいぞう 装置 そうち 中心 ちゅうしん 的 てき 構成 こうせい 要素 ようそ リボソームRNA (rRNA)の2種類 しゅるい 必要 ひつよう
mRNAの概念 がいねん 年 ねん シドニー・ブレナー とフランシス・クリック によって発展 はってん 歴史 れきし 参照 さんしょう 実験 じっけん 検証 けんしょう 行 おこな 過程 かてい フランソワ・ジャコブ とジャック・モノー が「メッセンジャーRNA(messenger RNA )」という名称 めいしょう 作 つく 出 だ 年 ねん ジェームズ・ワトソン の研究 けんきゅう マシュー・メセルソン のチームによって、mRNAが単 たん 離 はな 独立 どくりつ 記述 きじゅつ
RNAポリメラーゼ酵素 こうそ 黄色 おうしょく 鎖 くさり 転写 てんしゃ 緑色 みどりいろ 形成 けいせい mRNA分子 ぶんし 転写 てんしゃ 始 はじ 最終 さいしゅう 的 てき 分解 ぶんかい 短 みじか 生涯 しょうがい 終 お 分子 ぶんし 寿命 じゅみょう 間 あいだ 翻訳 ほんやく 前 まえ プロセシング 、編集 へんしゅう 輸送 ゆそう 真 ま 核 かく 生物 せいぶつ 分子 ぶんし 広範 こうはん 輸送 ゆそう 必要 ひつよう 原核 げんかく 生物 せいぶつ 分子 ぶんし 真 ま 核 かく 生物 せいぶつ 分子 ぶんし 結合 けつごう タンパク質 たんぱくしつ 合 あ メッセンジャーRNP (英語 えいご 版 ばん 呼 よ
DNAからRNAをコピーすることを転写 てんしゃ 転写 てんしゃ 際 さい RNAポリメラーゼ は必要 ひつよう 応 おう 遺伝子 いでんし 作成 さくせい 過程 かてい 真 ま 核 かく 生物 せいぶつ 原核 げんかく 生物 せいぶつ 相違 そうい 顕著 けんちょ 相違 そうい 一 ひと 原核 げんかく 生物 せいぶつ 転写 てんしゃ 中 ちゅう 処理 しょり 酵素 こうそ 結合 けつごう 転写 てんしゃ 中 ちゅう 進 すす 新 あたら 鎖 くさり 鎖 くさり 呼 よ 相補 そうほ 鎖 くさり 生成 せいせい 二 に 本 ほん 鎖 くさり 両者 りょうしゃ 結合 けつごう 塩基 えんき 対 たい 形成 けいせい 構造 こうぞう 形成 けいせい 鋳型 いがた 相補 そうほ 鎖 くさり 結合 けつごう アンチコドン 配列 はいれつ 同 おな 配列 はいれつ 短命 たんめい 未 み 部分 ぶぶん 的 てき 転写 てんしゃ 産物 さんぶつ 前駆 ぜんく 体 たい pre-mRNA 呼 よ 完全 かんぜん 成熟 せいじゅく 呼 よ
真 ま 核 かく 生物 せいぶつ [ 編集 へんしゅう ] (上段 じょうだん 遺伝子 いでんし 転写 てんしゃ 中段 ちゅうだん 後 ご 経 へ 成熟 せいじゅく 形成 けいせい 下段 げだん 最終 さいしゅう 的 てき 成熟 せいじゅく 翻訳 ほんやく タンパク質 たんぱくしつ 生成 せいせい mRNAのプロセシングは、真 ま 核 かく 生物 せいぶつ 細菌 さいきん 古 こ 細菌 さいきん 間 あいだ 大 おお 異 こと 非 ひ 真 ま 核 かく 生物 せいぶつ 本質 ほんしつ 的 てき 転写 てんしゃ 時点 じてん 成熟 せいじゅく 場合 ばあい 除 のぞ 必要 ひつよう [ 1] 真 ま 核 かく 生物 せいぶつ 細胞 さいぼう 質 しつ 輸送 ゆそう 翻訳 ほんやく 前 まえ 一連 いちれん 段階 だんかい 経 へ 必要 ひつよう
RNAスプライシング は、真 ま 核 かく 生物 せいぶつ 成熟 せいじゅく 至 いた 広範 こうはん イントロン やアウトロン (非 ひ 領域 りょういき 除去 じょきょ エクソン (コード領域 りょういき 結合 けつごう 機構 きこう
真 ま 核 かく 生物 せいぶつ 構造 こうぞう 左上 ひだりうえ 酸 さん 結合 けつごう 中央 ちゅうおう 介 かい 最初 さいしょ 転写 てんしゃ 右 みぎ 下 か 結合 けつごう 形成 けいせい 5'キャップ 5' cap、 RNAキャップ、RNA 7-メチルグアノシン キャップ、RNA m7 Gキャップとも呼 よ 真 ま 核 かく 生物 せいぶつ 転写 てんしゃ 開始 かいし 直後 ちょくご 先端 せんたん 部 ぶ 5'末端 まったん に付加 ふか 修飾 しゅうしょく グアニン ヌクレオチドである。5'キャップは、末端 まったん 残 ざん 基 もと 酸 さん 結合 けつごう 介 かい 最初 さいしょ 転写 てんしゃ 結 むす 存在 そんざい リボソーム による認識 にんしき リボヌクレアーゼ (RNase)酵素 こうそ 保護 ほご 重要 じゅうよう
キャップの付加 ふか 転写 てんしゃ 連動 れんどう 相互 そうご 影響 えいきょう 与 あた 共 きょう 転写 てんしゃ 的 てき 行 おこな 転写 てんしゃ 開始 かいし 直後 ちょくご 合成 ごうせい 末端 まったん RNAポリメラーゼ に結合 けつごう キャップ結合 けつごう 複 ふく 合体 がったい (英語 えいご 版 ばん 結合 けつごう 酵素 こうそ 複 ふく 合体 がったい 必要 ひつよう 化学 かがく 反応 はんのう 触媒 しょくばい 合成 ごうせい 多 た 段階 だんかい 生化学 せいかがく 反応 はんのう 進行 しんこう
場合 ばあい 編集 へんしゅう 組成 そせい 変化 へんか 例 れい アポリポタンパク質 しつ (英語 えいご 版 ばん 組織 そしき 編集 へんしゅう 他 た 組織 そしき 編集 へんしゅう 編集 へんしゅう 中途 ちゅうと 終止 しゅうし 作 つく 翻訳 ほんやく 時 じ 短 みじか タンパク質 たんぱくしつ 生成 せいせい
ポリアデニル化 か 過程 かてい ポリアデニル化 か (polyadenylation )とは、メッセンジャーRNA分子 ぶんし 部 ぶ 共有 きょうゆう 結合 けつごう 真 ま 核 かく 生物 せいぶつ 分子 ぶんし 末端 まったん 化 か 最近 さいきん 研究 けんきゅう ウリジン の短 みじか 伸長 しんちょう 化 か 一般 いっぱん 的 てき 示 しめ [ 2] ポリ(A)テール とそれに結合 けつごう タンパク質 たんぱくしつ エキソヌクレアーゼ による分解 ぶんかい 保護 ほご 助 たす 化 か 転写 てんしゃ 終結 しゅうけつ 核 かく 外 がい 輸送 ゆそう 翻訳 ほんやく 重要 じゅうよう 原核 げんかく 生物 せいぶつ 化 か 分解 ぶんかい 妨 さまた 促進 そくしん 作用 さよう
ポリアデニル化 か 転写 てんしゃ 際 さい 直後 ちょくご 起 お 転写 てんしゃ 終了 しゅうりょう 結合 けつごう 複 ふく 合体 がったい 働 はたら 鎖 くさり 切断 せつだん 切断 せつだん 後 のち 切断 せつだん 部位 ぶい 遊離 ゆうり 末端 まったん 約 やく 残 ざん 基 もと 付加 ふか 反応 はんのう ポリアデニル酸 さん (英語 えいご 版 ばん 触媒 しょくばい 選択 せんたく 的 てき 同様 どうよう 複数 ふくすう 種 しゅ 化 か 変異 へんい 体 たい 存在 そんざい 可能 かのう 性 せい
また、ポリアデニル化 か 部位 ぶい 変異 へんい 起 お 遺伝子 いでんし 一 いち 次 じ 転写 てんしゃ 産物 さんぶつ 付加 ふか 部位 ぶい 切断 せつだん 末端 まったん 個 こ 残 ざん 基 もと 付加 ふか 部位 ぶい 変化 へんか 異常 いじょう 長 なが 不安定 ふあんてい 形成 けいせい
真 ま 核 かく 生物 せいぶつ 原核 げんかく 生物 せいぶつ 一 ひと 違 ちが 輸送 ゆそう 関 かん 真 ま 核 かく 生物 せいぶつ 転写 てんしゃ 翻訳 ほんやく 区画 くかく 的 てき 分割 ぶんかつ 真 ま 核 かく 生物 せいぶつ 細胞 さいぼう 核 かく 細胞 さいぼう 質 しつ 輸送 ゆそう 過程 かてい シグナル伝達 でんたつ 経路 けいろ によって制御 せいぎょ 可能 かのう 性 せい [ 3] 成熟 せいじゅく 修飾 しゅうしょく 処理 しょり 認識 にんしき キャップ結合 けつごう タンパク質 たんぱくしつ (英語 えいご 版 ばん [ 4] 転写 てんしゃ 核 かく 外 がい 輸送 ゆそう 複 ふく 合体 がったい 結合 けつごう 核 かく 膜 まく 孔 あな 輸送 ゆそう [ 5] [ 6] 真 ま 核 かく 生物 せいぶつ 複数 ふくすう 輸送 ゆそう 経路 けいろ 同定 どうてい [ 7]
空間 くうかん 的 てき 複雑 ふくざつ 細胞 さいぼう 特定 とくてい 細胞 さいぼう 内 ない 目的 もくてき 地 ち 輸送 ゆそう 成熟 せいじゅく 神経 しんけい 細胞 さいぼう 種 しゅ 神経 しんけい 細胞 さいぼう 体 たい 樹 き 状 じょう 突起 とっき 輸送 ゆそう 翻訳 ほんやく 行 おこな 部位 ぶい 一 いち 例 れい 下 した 選択 せんたく 的 てき 局在 きょくざい ポリリボソーム である[ 8] Arc/Arg3.1 のmRNAは、シナプス活動 かつどう 誘導 ゆうどう NMDA受容 じゅよう 体 たい が生成 せいせい 基 もと 活動 かつどう 的 てき 近傍 きんぼう 選択 せんたく 的 てき 局在 きょくざい [ 9] β べーた (英語 えいご 版 ばん 外部 がいぶ 刺激 しげき 応答 おうとう 樹 き 状 じょう 突起 とっき 移動 いどう [ 10] アクチン のmRNAは、細胞 さいぼう 核 かく 輸送 ゆそう ZBP1 (英語 えいご 版 ばん 40Sサブユニット (英語 えいご 版 ばん 結合 けつごう 複 ふく 合体 がったい モータータンパク質 たんぱくしつ によって結合 けつごう 細胞 さいぼう 骨格 こっかく 沿 そ 目的 もくてき 位置 いち 神経 しんけい 突起 とっき 伸長 しんちょう 部 ぶ 輸送 ゆそう 最終 さいしゅう 的 てき Src (英語 えいご 版 ばん リン酸化 さんか され、翻訳 ほんやく 開始 かいし [ 11] 発達 はったつ 中 ちゅう 神経 しんけい 細胞 さいぼう 成長 せいちょう 中 ちゅう 軸 じく 索 さく 特 とく 成長 せいちょう 円錐 えんすい 輸送 ゆそう 多 おお 特定 とくてい 場所 ばしょ 輸送 ゆそう 郵便 ゆうびん 番号 ばんごう 意 い 付与 ふよ [ 12] 細胞 さいぼう 膜 まく 呼 よ 構造 こうぞう 体 たい 通 つう 哺乳 ほにゅう 動物 どうぶつ 細胞 さいぼう 間 あいだ 移動 いどう [ 13] [ 14]
mRNAからタンパク質 たんぱくしつ 翻訳 ほんやく 示 しめ 模 も 式 しき 図 ず リボソーム (緑 みどり 一連 いちれん 伝令 でんれい 黄 き 緑 みどり 転移 てんい 黄 き 結 むす アミノ酸 あみのさん 赤丸 あかまる 所定 しょてい タンパク質 たんぱくしつ 赤丸 あかまる 連鎖 れんさ 組 く 立 た 原核 げんかく 生物 せいぶつ 輸送 ゆそう 必要 ひつよう 転写 てんしゃ 終了 しゅうりょう 後 ご リボソーム により翻訳 ほんやく 開始 かいし 原核 げんかく 生物 せいぶつ 翻訳 ほんやく 転写 てんしゃ 共役 きょうやく 共 きょう 転写 てんしゃ 的 てき 行 おこな 言 い
真 ま 核 かく 生物 せいぶつ 細胞 さいぼう 質 しつ 輸送 ゆそう 後 のち 成熟 せいじゅく 翻訳 ほんやく 翻訳 ほんやく 細胞 さいぼう 質 しつ 内 ない 自由 じゆう 浮遊 ふゆう 起 お 場合 ばあい シグナル認識 にんしき 粒子 りゅうし によって誘導 ゆうどう 小 しょう 結合 けつごう 起 お 場合 ばあい 原核 げんかく 生物 せいぶつ 異 こと 真 ま 核 かく 生物 せいぶつ 翻訳 ほんやく 転写 てんしゃ 直接的 ちょくせつてき 結 むす 乳癌 にゅうがん 監視 かんし EEF1A1 (英語 えいご 版 ばん タンパク質 たんぱくしつ 低下 ていか タンパク質 たんぱくしつ 上昇 じょうしょう 伴 ともな [ 15] [要 よう 非 ひ 一 いち 次 じ 資料 しりょう 。
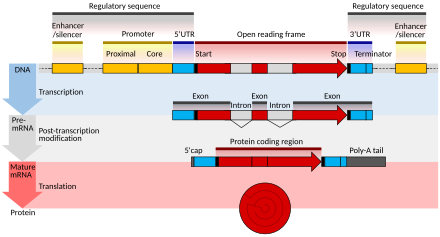
成熟 せいじゅく 真 ま 核 かく 生物 せいぶつ 構造 こうぞう 完全 かんぜん 左 ひだり 右 みぎ 5'キャップ 、5' UTR 、コーディング領域 りょういき 、3' UTR 、およびポリ(A)テール から構成 こうせい コーディング領域 りょういき (coding regions )はコドン (遺伝 いでん 暗号 あんごう 構成 こうせい 解読 かいどく タンパク質 たんぱくしつ 翻訳 ほんやく 真 ま 核 かく 生物 せいぶつ 通常 つうじょう 対 たい 原核 げんかく 生物 せいぶつ 通常 つうじょう 複数 ふくすう 領域 りょういき 開始 かいし 始 はじ 終止 しゅうし 終 お 一般 いっぱん 開始 かいし 終止 しゅうし 領域 りょういき 内部 ないぶ 塩基 えんき 対 たい 安定 あんてい 化 か 傾向 けいこう 分解 ぶんかい 妨 さまた [ 16] [ 17] 領域 りょういき タンパク質 たんぱくしつ コードする ことに加 くわ 一部 いちぶ エクソン性 せい (英語 えいご 版 ばん エクソン性 せい (英語 えいご 版 ばん pre-mRNA 中 なか 制御 せいぎょ 配列 はいれつ (英語 えいご 版 ばん 機能 きのう
真 ま 核 かく 生物 せいぶつ 非 ひ 翻訳 ほんやく 領域 りょういき 非 ひ 翻訳 ほんやく 領域 りょういき 一般 いっぱん 的 てき 構造 こうぞう 示 しめ 非 ひ 翻訳 ほんやく 領域 りょういき untranslated regions 、UTR)は、mRNAのうち、開始 かいし 前 ぜん 停止 ていし 後 のち 翻訳 ほんやく 領域 りょういき 5' 非 ひ 翻訳 ほんやく 領域 りょういき (5' UTR)と3' 非 ひ 翻訳 ほんやく 領域 りょういき (3' UTR)と呼 よ 領域 りょういき 領域 りょういき 一緒 いっしょ 転写 てんしゃ 成熟 せいじゅく 中 ちゅう 存在 そんざい エクソン性 せい (exonic )という。遺伝子 いでんし 発現 はつげん 関 かか 非 ひ 翻訳 ほんやく 領域 りょういき 役割 やくわり 安定 あんてい 性 せい 局在 きょくざい 化 か 翻訳 ほんやく 効率 こうりつ (英語 えいご 版 ばん 起因 きいん 機能 きのう 果 は 配列 はいれつ 依存 いぞん 種類 しゅるい 異 こと 可能 かのう 性 せい 遺伝子 いでんし 変異 へんい 構造 こうぞう タンパク質 たんぱくしつ 翻訳 ほんやく 変化 へんか 疾患 しっかん 感受性 かんじゅせい 関与 かんよ 考 かんが [ 18]
mRNAの安定 あんてい 性 せい リボヌクレアーゼ というRNA分解 ぶんかい 酵素 こうそ 分解 ぶんかい 促進 そくしん 阻害 そがい 補助 ほじょ タンパク質 たんぱくしつ 対 たい 親和 しんわ 性 せい 異 こと 制御 せいぎょ 可能 かのう 性 せい Cリッチ安定 あんてい 化 か 配列 はいれつ (英語 えいご 版 ばん 参照 さんしょう
翻訳 ほんやく 効率 こうりつ 時 とき 翻訳 ほんやく 完全 かんぜん 阻害 そがい 含 ふく 制御 せいぎょ 結合 けつごう タンパク質 たんぱくしつ 結合 けつごう 能力 のうりょく 働 はたら 翻訳 ほんやく 影響 えいきょう 及 およ 可能 かのう 性 せい 結合 けつごう マイクロRNA (miRNA)も、翻訳 ほんやく 効率 こうりつ 安定 あんてい 性 せい 影響 えいきょう 及 およ 可能 かのう 性 せい
mRNAの細胞 さいぼう 質 しつ 局在 きょくざい 性 せい 機能 きのう 考 かんが 細胞 さいぼう 内 ない 特定 とくてい 領域 りょういき 必要 ひつよう タンパク質 たんぱくしつ 場所 ばしょ 翻訳 ほんやく 場合 ばあい 転写 てんしゃ 産物 さんぶつ 翻訳 ほんやく 領域 りょういき 局在 きょくざい 化 か 配列 はいれつ 含 ふく 可能 かのう 性 せい
非 ひ 翻訳 ほんやく 領域 りょういき 含 ふく 配列 はいれつ 中 なか 転写 てんしゃ 特徴 とくちょう 的 てき 二 に 次 じ 構造 こうぞう 形成 けいせい 構造 こうぞう 的 てき 配列 はいれつ 調節 ちょうせつ 関与 かんよ SECIS配列 はいれつ (英語 えいご 版 ばん タンパク質 たんぱくしつ 結合 けつごう 標的 ひょうてき 配列 はいれつ 一種 いっしゅ リボスイッチ は、小 しょう 分子 ぶんし 直接 ちょくせつ 結合 けつごう 折 お 変化 へんか 転写 てんしゃ 翻訳 ほんやく 変更 へんこう 場合 ばあい 自身 じしん 制御 せいぎょ
3'ポリ(A)テール(3' poly(A) tail )は、pre-mRNAの3'末端 まったん 付加 ふか アデニン ヌクレオチドの長 なが 配列 はいれつ 配列 はいれつ 長 ちょう 数 すう 個 こ 多 おお 尾 お 部 ぶ 細胞 さいぼう 核 かく 輸送 ゆそう 翻訳 ほんやく 促進 そくしん 分解 ぶんかい 保護 ほご 役割 やくわり 持 も
型 がた 型 がた 違 ちが [ 編集 へんしゅう ] mRNA分子 ぶんし 単一 たんいつ タンパク質 たんぱくしつ 鎖 くさり 翻訳 ほんやく 遺伝 いでん 情報 じょうほう 含 ふく 場合 ばあい 型 がた monocistronic mRNA )であるという。ほとんどの真 ま 核 かく 生物 せいぶつ [ 19] [ 20] 一方 いっぽう 型 がた polycistronic mRNA )mRNAは、複数 ふくすう オープン・リーディング・フレーム (ORF)を持 も 翻訳 ほんやく 通常 つうじょう 関連 かんれん 機能 きのう 持 も 多 おお 最終 さいしゅう 的 てき 複 ふく 合 あい タンパク質 たんぱくしつ 構成 こうせい 配列 はいれつ coding sequence 、CDS)はプロモーター とオペレーター を含 ふく 制御 せいぎょ 領域 りょういき 全体 ぜんたい 制御 せいぎょ 細菌 さいきん 古 こ 細菌 さいきん 見 み 型 がた ミトコンドリア ・ゲノム も同様 どうよう [ 19] 型 がた dicistronic )またはバイシストロン型 がた bicistronic )のmRNAは、2つのタンパク質 たんぱくしつ [ 21]
mRNAの環状 かんじょう 化 か 調節 ちょうせつ 詳細 しょうさい 画像 がぞう 概要 がいよう 参照 さんしょう 真 ま 核 かく 生物 せいぶつ eIF4E とポリ(A)結合 けつごう タンパク質 たんぱくしつ (PABP)が相互 そうご 作用 さよう 両者 りょうしゃ 足場 あしば タンパク質 たんぱくしつ eIF4G (英語 えいご 版 ばん 結合 けつごう タンパク質 たんぱくしつ 橋渡 はしわた 分子 ぶんし 環状 かんじょう 構造 こうぞう 形成 けいせい [ 22] 環状 かんじょう 化 か 上 じょう 循環 じゅんかん 促進 そくしん 時間 じかん 効率 こうりつ 翻訳 ほんやく 考 かんが 無傷 むきず 翻訳 ほんやく 機能 きのう 可能 かのう 性 せい 部分 ぶぶん 的 てき 分解 ぶんかい 7 Gキャップやポリ(A)テールの欠 かけ 失 しつ 特徴 とくちょう [ 23]
この他 ほか 特 とく 環状 かんじょう 化 か 機構 きこう 知 し ポリオウイルス のmRNAは、その5'末端 まったん 方向 ほうこう 部分 ぶぶん 利用 りよう タンパク質 たんぱくしつ PCBP2 (英語 えいご 版 ばん 結合 けつごう 結合 けつごう タンパク質 たんぱくしつ 結合 けつごう 知 し タンパク質 たんぱくしつ 輪 わ 形成 けいせい オオムギ黄 き 化 か 萎縮 いしゅく (英語 えいご 版 ばん 末端 まったん 末端 まったん 間 あいだ 結合 けつごう キッシングステムループ (英語 えいご 版 ばん 呼 よ タンパク質 たんぱくしつ 介 かい 環状 かんじょう 化 か
RNAウイルスゲノム(その+鎖 くさり 翻訳 ほんやく 一般 いっぱん 環状 かんじょう 化 か [要 よう 出典 しゅってん 。ゲノム複製 ふくせい 際 さい 環状 かんじょう 化 か 複製 ふくせい 速度 そくど 高 たか 作用 さよう 循環 じゅんかん 仮説 かせつ 同様 どうよう RNA依存 いぞん 性 せい を循環 じゅんかん
同 おな 細胞 さいぼう 内 ない 寿命 じゅみょう 安定 あんてい 性 せい 異 こと 細菌 さいきん 細胞 さいぼう 個々 ここ 数 すう 秒 びょう 時間 じかん 以上 いじょう 生存 せいぞん 寿命 じゅみょう 平均 へいきん 分 ふん 細菌 さいきん 真 ま 核 かく 生物 せいぶつ 安定 あんてい 性 せい 低 ひく [ 24] 哺乳 ほにゅう 動物 どうぶつ 細胞 さいぼう 寿命 じゅみょう 数 すう 分 ふん 数日 すうじつ 及 およ [ 25] 安定 あんてい 性 せい 高 たか 多 おお タンパク質 たんぱくしつ 生成 せいせい 可能 かのう 性 せい 寿命 じゅみょう 限 かぎ 細胞 さいぼう 変化 へんか 需要 じゅよう 応 おう タンパク質 たんぱくしつ 合成 ごうせい 速 すみ 変更 へんこう 破壊 はかい 多 おお 機構 きこう 次 つぎ 説明 せつめい
さまざまな生命 せいめい 分解 ぶんかい 経路 けいろ 概要 がいよう 陰性 いんせい 大腸菌 だいちょうきん 陽性 ようせい 枯草 かれくさ 菌 きん 左上 ひだりうえ 右上 みぎうえ 代表 だいひょう 主要 しゅよう 細菌 さいきん 系統 けいとう 経路 けいろ 類似 るいじ 酵素 こうそ 異 こと 陰性 いんせい 陽性 ようせい 両方 りょうほう 基質 きしつ 繰 く 返 かえ 切断 せつだん 生成 せいせい 物 ぶつ 攻撃 こうげき 比較 ひかく 真 ま 核 かく 生物 せいぶつ 分解 ぶんかい 経路 けいろ 示 しめ 右上 みぎうえ 一般 いっぱん 的 てき 原核 げんかく 生物 せいぶつ 真 ま 核 かく 生物 せいぶつ 寿命 じゅみょう 短 みじか 原核 げんかく 生物 せいぶつ エンドヌクレアーゼ 、3'エキソヌクレアーゼ 、および5'エキソヌクレアーゼを含 ふく 組 く 合 あ 意 い 分解 ぶんかい 数 すう 十 じゅう 数 すう 百 ひゃく 長 ちょう 小型 こがた (英語 えいご 版 ばん 相補 そうほ 的 てき 配列 はいれつ 塩基 えんき 対 たい 形成 けいせい RNase III (英語 えいご 版 ばん 切断 せつだん 促進 そくしん 特定 とくてい 分解 ぶんかい 促 うなが 場合 ばあい 最近 さいきん 細菌 さいきん 末端 まったん 三 さん 酸 さん 一種 いっしゅ 持 も 明 あき [ 26] 酸 さん 除去 じょきょ 酸 さん 残 のこ 分解 ぶんかい 破壊 はかい
真 ま 核 かく 細胞 さいぼう 内 ない 翻訳 ほんやく 分解 ぶんかい 間 あいだ 釣 つ 合 あ 保 たも 活発 かっぱつ 翻訳 ほんやく リボソーム 、真 ま 核 かく 生物 せいぶつ 翻訳 ほんやく 開始 かいし 因子 いんし eIF4E およびeIF4G (英語 えいご 版 ばん ポリ(A)結合 けつごう タンパク質 たんぱくしつ によって結合 けつごう 酵素 こうそ DCP2 (英語 えいご 版 ばん 阻害 そがい 結合 けつごう タンパク質 たんぱくしつ エキソソーム複 ふく 合体 がったい を阻害 そがい 末端 まったん 保護 ほご 翻訳 ほんやく 分解 ぶんかい 釣 つ 合 あ Pボディ (英語 えいご 版 ばん P-bodies )という細胞 さいぼう 質 しつ 構造 こうぞう 大 おお 存在 そんざい 量 りょう 反映 はんえい [ 27] ポリ(A)テール は、RNA上 じょう 制御 せいぎょ 配列 はいれつ 作用 さよう 性 せい 結合 けつごう タンパク質 たんぱくしつ 組 く 合 あ 特定 とくてい 標的 ひょうてき 特殊 とくしゅ 短縮 たんしゅく 除去 じょきょ 環状 かんじょう 構造 こうぞう 破壊 はかい キャップ結合 けつごう 複 ふく 合体 がったい (英語 えいご 版 ばん 不安定 ふあんてい 化 か 考 かんが 後 ご 複 ふく 合体 がったい デキャッピング複 ふく 合体 がったい (英語 えいご 版 ばん 分解 ぶんかい 翻訳 ほんやく 的 てき 不 ふ 活性 かっせい 速 すみ 破壊 はかい 活性 かっせい 無傷 むきず 残 のこ 翻訳 ほんやく 停止 ていし 崩壊 ほうかい 複 ふく 合体 がったい 渡 わた 機構 きこう 詳 くわ 分 わ
一部 いちぶ 哺乳類 ほにゅうるい 中 ちゅう AU えーゆー (英語 えいご 版 ばん 存在 そんざい 配列 はいれつ 結合 けつごう ポリ(A)テール の除去 じょきょ 促 うなが 細胞 さいぼう タンパク質 たんぱくしつ 作用 さよう 転写 てんしゃ 産物 さんぶつ 不安定 ふあんてい 化 か 傾向 けいこう 欠 かけ 失 しつ エキソソーム複 ふく 合体 がったい [ 28] デキャッピング複 ふく 合体 がったい (英語 えいご 版 ばん [ 29] 両方 りょうほう 攻撃 こうげき 促進 そくしん 分解 ぶんかい 促進 そくしん 考 かんが AU えーゆー 介 かい 速 すみ 分解 ぶんかい 腫瘍 しゅよう 壊死 えし 因子 いんし 顆粒 かりゅう 球 だま 刺激 しげき 因子 いんし 強力 きょうりょく サイトカイン の過剰 かじょう 産 さん 生 せい 防 ふせ 重要 じゅうよう 機構 きこう [ 30] AU えーゆー c-Jun やc-Fos などの発 はつ 性 せい 転写 てんしゃ 因子 いんし 生 なま 合成 ごうせい 調節 ちょうせつ [ 31]
変異 へんい 依存 いぞん 分解 ぶんかい 機構 きこう [ 編集 へんしゅう ] 真 ま 核 かく 生物 せいぶつ 中 ちゅう 中途 ちゅうと 終止 しゅうし ナンセンスコドン )の存在 そんざい ナンセンス変異 へんい 依存 いぞん 分解 ぶんかい 機構 きこう (NMD)による監視 かんし 受 う 不完全 ふかんぜん 適応 てきおう 免疫 めんえき 系 けい V(D)J遺伝子 いでんし 再 さい 構成 こうせい 、DNAの変異 へんい 転写 てんしゃ フレームシフト (英語 えいご 版 ばん 引 ひ 起 お 漏出 ろうしゅつ (英語 えいご 版 ばん 他 た 原因 げんいん 発生 はっせい 可能 かのう 性 せい 中途 ちゅうと 終止 しゅうし 検出 けんしゅつ 除去 じょきょ ポリ(A) テール除去 じょきょ ヌクレオチド鎖 くさり 切断 せつだん による分解 ぶんかい 引 ひ 起 お [ 32]
低 てい 分子 ぶんし 干渉 かんしょう [ 編集 へんしゅう ] 後生 ごしょう 動物 どうぶつ 酵素 こうそ Dicer によって処理 しょり 低 てい 分子 ぶんし 干渉 かんしょう RNA誘導 ゆうどう 複 ふく 合体 がったい またはRISC(RNA-induced silencing complex)として知 し 複 ふく 合体 がったい 取 と 込 こ 複 ふく 合 あい エンドヌクレアーゼ を含 ふく 結合 けつごう 完全 かんぜん 相補 そうほ 的 てき 切断 せつだん 結果 けっか 生 しょう 断片 だんぺん エキソヌクレアーゼ によって破壊 はかい 細胞 さいぼう 培養 ばいよう 遺伝子 いでんし 機能 きのう 阻害 そがい 実験 じっけん 室 しつ 一般 いっぱん 的 てき 使用 しよう 二 に 本 ほん 鎖 くさり 対 たい 防御 ぼうぎょ 自然 しぜん 免疫 めんえき 系 けい 一部 いちぶ 考 かんが [ 33]
マイクロRNA (miRNA)は、通常 つうじょう 後生 ごしょう 動物 どうぶつ 部分 ぶぶん 相補 そうほ 的 てき 配列 はいれつ 持 も 小型 こがた [ 34] [ 35] 結合 けつごう 翻訳 ほんやく 抑制 よくせい 除去 じょきょ 促進 そくしん 分解 ぶんかい 早 はや 作用 さよう 機 き 序 じょ 活発 かっぱつ 研究 けんきゅう 対象 たいしょう [ 36] [ 37]
メッセージが分解 ぶんかい 機構 きこう 他 ほか ノンストップ分解 ぶんかい (英語 えいご 版 ばん non-stop decay 、NSD)や、Piwi結合 けつごう (英語 えいご 版 ばん Piwi-interacting RNA 、piRNA)によるサイレンシング など、さまざまなものがある。
ヌクレオシド修飾 しゅうしょく (modRNA)配列 はいれつ 投与 とうよ 細胞 さいぼう タンパク質 たんぱくしつ 作 つく 直接的 ちょくせつてき タンパク質 たんぱくしつ 病気 びょうき 治療 ちりょう ワクチン として機能 きのう 可能 かのう 性 せい 間接 かんせつ 的 てき タンパク質 たんぱくしつ 内在 ないざい 性 せい 幹 みき 細胞 さいぼう 望 のぞ 方法 ほうほう 分化 ぶんか 可能 かのう 性 せい [ 38] [ 39]
RNA治療 ちりょう 主 おも 課題 かだい 適切 てきせつ 細胞 さいぼう 送達 そうたつ [ 40] 課題 かだい 裸 はだか 配列 はいれつ 調剤 ちょうざい 後 ご 自然 しぜん 分解 ぶんかい 身体 しんたい 免疫 めんえき 系 けい 侵入 しんにゅう 者 しゃ 攻撃 こうげき 可能 かのう 性 せい 細胞 さいぼう 膜 まく 通過 つうか 事実 じじつ 含 ふく [ 39] 細胞 さいぼう 内 ない 入 はい 後 のち 必要 ひつよう リボソーム がある細胞 さいぼう 質 しつ 活動 かつどう 細胞 さいぼう 輸送 ゆそう 機構 きこう 離 はな [ 38]
これらの課題 かだい 克服 こくふく 年 ねん 広 ひろ 適用 てきよう 可能 かのう in vitro トランスフェクション技術 ぎじゅつ が開発 かいはつ 後 のち [ 41] 治療 ちりょう 薬 やく 初 はじ 提唱 ていしょう 年代 ねんだい 非 ひ 修飾 しゅうしょく 依存 いぞん 個別 こべつ 化 か (英語 えいご 版 ばん 対 たい 開発 かいはつ 用 もち 治療 ちりょう 法 ほう 自己 じこ 免疫 めんえき 疾患 しっかん 代謝 たいしゃ 性 せい 疾患 しっかん 呼吸 こきゅう 器 き 炎症 えんしょう 性 せい 疾患 しっかん 対 たい 治療 ちりょう 法 ほう 処置 しょち 法 ほう 両面 りょうめん 研究 けんきゅう 続 つづ CRISPR (英語 えいご 版 ばん 遺伝子 いでんし 編集 へんしゅう 療法 りょうほう 目的 もくてき Cas タンパク質 たんぱくしつ 作 つく 細胞 さいぼう 誘導 ゆうどう 使用 しよう 有益 ゆうえき 可能 かのう 性 せい [ 42]
2010年代 ねんだい 以降 いこう 他 た 治療 ちりょう 薬 やく 新 あたら 医薬品 いやくひん 見 み [ 43] 最初 さいしょ 基 もと 制限 せいげん 付 つ 承認 しょうにん 受 う COVID-19パンデミック の間 あいだ ファイザー - バイオンテック やモデルナ によるCOVID-19ワクチン が世界中 せかいじゅう 展開 てんかい [ 44]
1950年代 ねんだい 初頭 しょとう 分子生物学 ぶんしせいぶつがく 研究 けんきゅう タンパク質 たんぱくしつ 合成 ごうせい 際 さい 関連 かんれん 分子 ぶんし 存在 そんざい 示唆 しさ 最 もっと 古 ふる 報告 ほうこく ジャック・モノー と彼 かれ 合成 ごうせい タンパク質 たんぱくしつ 合成 ごうせい 必要 ひつよう 示 しめ 特 とく 細菌 さいきん 大腸菌 だいちょうきん 酵素 こうそ β べーた 産 さん 生 せい 時 とき 必要 ひつよう 示 しめ [ 45] 年 ねん アーサー・パーディー (英語 えいご 版 ばん 同様 どうよう 蓄積 ちくせき 発見 はっけん [ 46] 年 ねん アルフレッド・ハーシー 、ジューン・ディクソン 、マーサ・チェイス は、大腸菌 だいちょうきん 内 ない 合成 ごうせい 後 ご 消失 しょうしつ 特定 とくてい 含有 がんゆう 示 しめ 報告 ほうこく [ 47] 存在 そんざい 示 しめ 最初 さいしょ 記録 きろく 特定 とくてい [ 48]
mRNAのアイディアは、1960年 ねん 月 がつ 日 にち キングス・カレッジ で、シドニー・ブレナー とフランシス・クリックによって最初 さいしょ 着想 ちゃくそう フランソワ・ジャコブ が、アーサー・パーディー、ジャコブ、そしてモノーが最近 さいきん 行 おこな 実験 じっけん 話 はな 励 はげ 受 う 新 あたら 仮説 かせつ 検証 けんしょう 着手 ちゃくしゅ カリフォルニア工科 こうか 大学 だいがく のマシュー・メセルソン に連絡 れんらく 取 と 年 ねん 夏 なつ 人 にん 工科 こうか 大学 だいがく 研究 けんきゅう 室 しつ 実験 じっけん 行 おこな 存在 そんざい 証明 しょうめい 年 とし 秋 あき メッセンジャーRNA (messenger RNA )」と命名 めいめい 機能 きのう 説明 せつめい 最初 さいしょ 理論 りろん 的 てき 枠組 わくぐ 構築 こうちく [ 48]
1961年 ねん 月 がつ ジェームズ・ワトソン は、自身 じしん 研究 けんきゅう 彼 かれ 後 ご 同 おな 方向 ほうこう 同様 どうよう 実験 じっけん 行 おこな 明 あき 他 た 人 ひと 彼 かれ 研究 けんきゅう 知見 ちけん 論文 ろんぶん 発表 はっぴょう 遅 おく 要請 ようせい 同意 どうい 結果 けっか 年 ねん 月 がつ ネイチャー 』誌 し 論文 ろんぶん 同時 どうじ 掲載 けいさい 同 おな 月 がつ ジャーナル・オブ・モレキュラー・バイオロジー (英語 えいご 版 ばん Journal of Molecular Biology )』誌 し 理論 りろん 的 てき 枠組 わくぐ 発表 はっぴょう [ 49] [ 48]
^ Watson JD (February 22, 2013). Molecular Biology of the Gene, 7th edition . Pearson Higher Ed USA. ISBN 9780321851499 ^ Choi YS, Patena W, Leavitt AD, McManus MT (March 2012). “Widespread RNA 3'-end oligouridylation in mammals” . RNA (New York, N.Y.) 18 (3): 394–401. doi :10.1261/rna.029306.111 . PMC 3285928 . PMID 22291204 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3285928/ . ^ Quaresma AJ, Sievert R, Nickerson JA (April 2013). “Regulation of mRNA export by the PI3 kinase/AKT signal transduction pathway” . Molecular Biology of the Cell 24 (8): 1208–1221. doi :10.1091/mbc.E12-06-0450 . PMC 3623641 . PMID 23427269 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3623641/ . ^ Kierzkowski D, Kmieciak M, Piontek P, Wojtaszek P, Szweykowska-Kulinska Z, Jarmolowski A (September 2009). “The Arabidopsis CBP20 targets the cap-binding complex to the nucleus, and is stabilized by CBP80”. The Plant Journal 59 (5): 814–825. doi :10.1111/j.1365-313X.2009.03915.x . PMID 19453442 . ^ Strässer K, Masuda S, Mason P, Pfannstiel J, Oppizzi M, Rodriguez-Navarro S, Rondón AG, Aguilera A, Struhl K, Reed R, Hurt E (May 2002). “TREX is a conserved complex coupling transcription with messenger RNA export”. Nature 417 (6886): 304–308. Bibcode : 2002Natur.417..304S . doi :10.1038/nature746 . PMID 11979277 . ^ Katahira J, Yoneda Y (27 October 2014). “Roles of the TREX complex in nuclear export of mRNA”. RNA Biology 6 (2): 149–152. doi :10.4161/rna.6.2.8046 . PMID 19229134 . ^ Cenik C, Chua HN, Zhang H, Tarnawsky SP, Akef A, Derti A, Tasan M, Moore MJ, Palazzo AF, Roth FP (April 2011). “Genome analysis reveals interplay between 5'UTR introns and nuclear mRNA export for secretory and mitochondrial genes” . PLOS Genetics 7 (4): e1001366. doi :10.1371/journal.pgen.1001366 . PMC 3077370 . PMID 21533221 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3077370/ . ^ Steward O, Levy WB (March 1982). “Preferential localization of polyribosomes under the base of dendritic spines in granule cells of the dentate gyrus” . The Journal of Neuroscience 2 (3): 284–291. doi :10.1523/JNEUROSCI.02-03-00284.1982 . PMC 6564334 . PMID 7062109 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6564334/ . ^ Steward O, Worley PF (April 2001). “Selective targeting of newly synthesized Arc mRNA to active synapses requires NMDA receptor activation”. Neuron 30 (1): 227–240. doi :10.1016/s0896-6273(01)00275-6 . PMID 11343657 . ^ Job C, Eberwine J (December 2001). “Localization and translation of mRNA in dendrites and axons”. Nature Reviews. Neuroscience 2 (12): 889–898. doi :10.1038/35104069 . PMID 11733796 . ^ Hüttelmaier S, Zenklusen D, Lederer M, Dictenberg J, Lorenz M, Meng X, Bassell GJ, Condeelis J, Singer RH (November 2005). “Spatial regulation of beta-actin translation by Src-dependent phosphorylation of ZBP1”. Nature 438 (7067): 512–515. Bibcode : 2005Natur.438..512H . doi :10.1038/nature04115 . PMID 16306994 . ^ Ainger K, Avossa D, Diana AS, Barry C, Barbarese E, Carson JH (September 1997). “Transport and localization elements in myelin basic protein mRNA” . The Journal of Cell Biology 138 (5): 1077–1087. doi :10.1083/jcb.138.5.1077 . PMC 2136761 . PMID 9281585 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2136761/ . ^ Haimovich G, Ecker CM, Dunagin MC, Eggan E, Raj A, Gerst JE, Singer RH (November 2017). “Intercellular mRNA trafficking via membrane nanotube-like extensions in mammalian cells” . Proceedings of the National Academy of Sciences of the United States of America 114 (46): E9873–E9882. doi :10.1073/pnas.1706365114 . PMC 5699038 . PMID 29078295 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5699038/ . ^ Haimovich G, Dasgupta S, Gerst JE (February 2021). “RNA transfer through tunneling nanotubes” . Biochemical Society Transactions 49 (1): 145–160. doi :10.1042/BST20200113 . PMID 33367488 . https://portlandpress.com/biochemsoctrans/article-abstract/49/1/145/227426/RNA-transfer-through-tunneling-nanotubes . ^ Lin CY, Beattie A, Baradaran B, Dray E, Duijf PH (September 2018). “Contradictory mRNA and protein misexpression of EEF1A1 in ductal breast carcinoma due to cell cycle regulation and cellular stress” . Scientific Reports 8 (1): 13904. Bibcode : 2018NatSR...813904L . doi :10.1038/s41598-018-32272-x . PMC 6141510 . PMID 30224719 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6141510/ . ^ Shabalina SA, Ogurtsov AY, Spiridonov NA (2006). “A periodic pattern of mRNA secondary structure created by the genetic code” . Nucleic Acids Research 34 (8): 2428–2437. doi :10.1093/nar/gkl287 . PMC 1458515 . PMID 16682450 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1458515/ . ^ Katz L, Burge CB (September 2003). “Widespread selection for local RNA secondary structure in coding regions of bacterial genes” . Genome Research 13 (9): 2042–2051. doi :10.1101/gr.1257503 . PMC 403678 . PMID 12952875 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC403678/ . ^ Lu YF, Mauger DM, Goldstein DB, Urban TJ, Weeks KM, Bradrick SS (November 2015). “IFNL3 mRNA structure is remodeled by a functional non-coding polymorphism associated with hepatitis C virus clearance” . Scientific Reports 5 : 16037. Bibcode : 2015NatSR...516037L . doi :10.1038/srep16037 . PMC 4631997 . PMID 26531896 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4631997/ . ^ a b Kozak M (March 1983). “Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles” . Microbiological Reviews 47 (1): 1–45. doi :10.1128/MMBR.47.1.1-45.1983 . PMC 281560 . PMID 6343825 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC281560/ .
^ Niehrs C, Pollet N (December 1999). “Synexpression groups in eukaryotes”. Nature 402 (6761): 483–487. Bibcode : 1999Natur.402..483N . doi :10.1038/990025 . PMID 10591207 . ^ Mercer TR, Neph S, Dinger ME, Crawford J, Smith MA, Shearwood AM, Haugen E, Bracken CP, Rackham O, Stamatoyannopoulos JA, Filipovska A, Mattick JS (August 2011). “The human mitochondrial transcriptome” . Cell 146 (4): 645–658. doi :10.1016/j.cell.2011.06.051 . PMC 3160626 . PMID 21854988 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3160626/ . ^ Wells SE, Hillner PE, Vale RD, Sachs AB (July 1998). “Circularization of mRNA by eukaryotic translation initiation factors”. Molecular Cell 2 (1): 135–140. doi :10.1016/S1097-2765(00)80122-7 . PMID 9702200 . ^ López-Lastra M, Rivas A, Barría MI (2005). “Protein synthesis in eukaryotes: the growing biological relevance of cap-independent translation initiation”. Biological Research 38 (2–3): 121–146. doi :10.4067/S0716-97602005000200003 . PMID 16238092 . ^ Lewin's genes X ISBN 9780763766320 . OCLC 456641931 . https://archive.org/details/lewinsgenesx0000unse ^ Yu J, Russell JE (September 2001). “Structural and functional analysis of an mRNP complex that mediates the high stability of human beta-globin mRNA” . Molecular and Cellular Biology 21 (17): 5879–5888. doi :10.1128/mcb.21.17.5879-5888.2001 . PMC 87307 . PMID 11486027 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC87307/ . ^ Deana A, Celesnik H, Belasco JG (January 2008). “The bacterial enzyme RppH triggers messenger RNA degradation by 5' pyrophosphate removal”. Nature 451 (7176): 355–358. Bibcode : 2008Natur.451..355D . doi :10.1038/nature06475 . PMID 18202662 . ^ Parker R, Sheth U (March 2007). “P bodies and the control of mRNA translation and degradation”. Molecular Cell 25 (5): 635–646. doi :10.1016/j.molcel.2007.02.011 . PMID 17349952 . ^ Chen CY, Gherzi R, Ong SE, Chan EL, Raijmakers R, Pruijn GJ, Stoecklin G, Moroni C, Mann M, Karin M (November 2001). “AU えーゆー Cell 107 (4): 451–464. doi :10.1016/S0092-8674(01)00578-5 . PMID 11719186 . ^ Fenger-Grøn M, Fillman C, Norrild B, Lykke-Andersen J (December 2005). “Multiple processing body factors and the ARE binding protein TTP activate mRNA decapping”. Molecular Cell 20 (6): 905–915. doi :10.1016/j.molcel.2005.10.031 . PMID 16364915 . ^ Shaw G, Kamen R (August 1986). “A conserved AU えーゆー Cell 46 (5): 659–667. doi :10.1016/0092-8674(86)90341-7 . PMID 3488815 . ^ Chen CY, Shyu AB (November 1995). “AU えーゆー Trends in Biochemical Sciences 20 (11): 465–470. doi :10.1016/S0968-0004(00)89102-1 . PMID 8578590 . ^ Isken O, Maquat LE (August 2007). “Quality control of eukaryotic mRNA: safeguarding cells from abnormal mRNA function”. Genes & Development 21 (15): 1833–1856. doi :10.1101/gad.1566807 . PMID 17671086 . ^ Obbard DJ, Gordon KH, Buck AH, Jiggins FM (January 2009). “The evolution of RNAi as a defence against viruses and transposable elements” . Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 364 (1513): 99–115. doi :10.1098/rstb.2008.0168 . PMC 2592633 . PMID 18926973 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2592633/ . ^ Robert E. Farrell, Jr. RNA Methodologies, 5th Edition. Academic Press, 2017
^ Brennecke J, Stark A, Russell RB, Cohen SM (March 2005). “Principles of microRNA-target recognition” . PLOS Biology 3 (3): e85. doi :10.1371/journal.pbio.0030085 . PMC 1043860 . PMID 15723116 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1043860/ . ^ Tasuku Honjo, Michael Reth, Andreas Radbruch, Frederick Alt. Molecular Biology of B Cells, 2nd Edition. Academic Press, 2014 (including "updated research on microRNAs")
^ Eulalio A, Huntzinger E, Nishihara T, Rehwinkel J, Fauser M, Izaurralde E (January 2009). “Deadenylation is a widespread effect of miRNA regulation” . RNA 15 (1): 21–32. doi :10.1261/rna.1399509 . PMC 2612776 . PMID 19029310 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2612776/ . ^ a b Hajj KA, Whitehead KA (12 September 2017). “Tools for translation: non-viral materials for therapeutic mRNA delivery”. Nature Reviews Materials 2 (10): 17056. Bibcode : 2017NatRM...217056H . doi :10.1038/natrevmats.2017.56 .
^ a b Gousseinov E, Kozlov M, Scanlan C (2015年 ねん 月 がつ 日 にち “RNA-Based Therapeutics and Vaccines” . Genetic Engineering News . https://www.genengnews.com/gen-exclusives/rna-based-therapeutics-and-vaccines/77900520
^ Kaczmarek JC, Kowalski PS, Anderson DG (June 2017). “Advances in the delivery of RNA therapeutics: from concept to clinical reality” . Genome Medicine 9 (1): 60. doi :10.1186/s13073-017-0450-0 . PMC 5485616 . PMID 28655327 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5485616/ . ^ Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ (November 2012). “Developing mRNA-vaccine technologies” . RNA Biology 9 (11): 1319–30. doi :10.4161/rna.22269 . PMC 3597572 . PMID 23064118 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3597572/ . ^ Haridi R (2021年 ねん 月 がつ 日 にち The mRNA revolution: How COVID-19 hit fast-forward on an experimental technology ” (英語 えいご New Atlas . 2021年 ねん 月 がつ 日 にち 閲覧 えつらん ^ Kowalska J, Wypijewska del Nogal A, Darzynkiewicz ZM, Buck J, Nicola C, Kuhn AN, Lukaszewicz M, Zuberek J, Strenkowska M, Ziemniak M, Maciejczyk M, Bojarska E, Rhoads RE, Darzynkiewicz E, Sahin U, Jemielity J (2014), “mRNA-based therapeutics–developing a new class of drugs.” (英語 えいご Nature Reviews Drug Discovery 13 (10): pp. 759–780, doi :10.1093/nar/gku757 , PMC 4176373 , PMID 25150148 , http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=4176373 ^ Barbier AJ, Jiang AY, Zhang P, Wooster R, Anderson DG (June 2022). “The clinical progress of mRNA vaccines and immunotherapies”. Nature Biotechnology 40 (6): 840–854. doi :10.1038/s41587-022-01294-2 . PMID 35534554 . ^ Monod J, Pappenheimer AM, Cohen-Bazire G (1952). “La cinétique de la biosynthèse de la β べーた フランス語 ふらんすご Biochimica et Biophysica Acta 9 (6): 648–660. doi :10.1016/0006-3002(52)90227-8 . PMID 13032175 . ^ Pardee AB (May 1954). “Nucleic Acid Precursors and Protein Synthesis” . Proceedings of the National Academy of Sciences of the United States of America 40 (5): 263–270. Bibcode : 1954PNAS...40..263P . doi :10.1073/pnas.40.5.263 . PMC 534118 . PMID 16589470 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC534118/ . ^ Hershey AD, Dixon J, Chase M (July 1953). “Nucleic acid economy in bacteria infected with bacteriophage T2. I. Purine and pyrimidine composition” . The Journal of General Physiology 36 (6): 777–789. doi :10.1085/jgp.36.6.777 . PMC 2147416 . PMID 13069681 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2147416/ . ^ a b c Cobb M (29 June 2015). “Who discovered messenger RNA?”. Current Biology 25 (13): R526–R532. doi :10.1016/j.cub.2015.05.032 . PMID 26126273 .
^ F. Jacob, J. Monod "Genetic regulatory mechanisms in the synthesis of proteins". Journal of Molecular Biology, 3 (1961), pp. 318-356.
Alsaweed M, Lai CT, Hartmann PE, Geddes DT, Kakulas F (February 2016). “Human milk miRNAs primarily originate from the mammary gland resulting in unique miRNA profiles of fractionated milk” . Scientific Reports 6 (1): 20680. Bibcode : 2016NatSR...620680A . doi :10.1038/srep20680 . PMC 4745068 . PMID 26854194 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4745068/ . Lillycrop KA, Burdge GC (October 2012). “Epigenetic mechanisms linking early nutrition to long term health”. Best Practice & Research. Clinical Endocrinology & Metabolism 26 (5): 667–676. doi :10.1016/j.beem.2012.03.009 . PMID 22980048 . Melnik BC, Kakulas F, Geddes DT, Hartmann PE, John SM, Carrera-Bastos P, Cordain L, Schmitz G (21 June 2016). “Milk miRNAs: simple nutrients or systemic functional regulators?” . Nutrition & Metabolism 13 (1): 42. doi :10.1186/s12986-016-0101-2 . PMC 4915038 . PMID 27330539 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4915038/ . Vickers MH (June 2014). “Early life nutrition, epigenetics and programming of later life disease” . Nutrients 6 (6): 2165–2178. doi :10.3390/nu6062165 . PMC 4073141 . PMID 24892374 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4073141/ . Zhou Q, Li M, Wang X, Li Q, Wang T, Zhu Q, Zhou X, Wang X, Gao X, Li X (2012). “Immune-related microRNAs are abundant in breast milk exosomes” . International Journal of Biological Sciences 8 (1): 118–123. doi :10.7150/ijbs.8.118 . PMC 3248653 . PMID 22211110 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3248653/ .