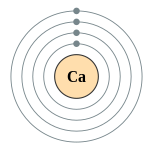
钙
钙(
雖然
鈣是
性 质
[编辑]归类
[编辑]钙是
碱土
物理 性 质
[编辑]钙的熔点
钙比铅
化学 性 质
[编辑]钙的
- 、
- 钙在
空 气中的 缓慢氧化[13]
钙单质与其氧
- 钙、锶、钡单质及其氧
化物 会 与 水 剧烈反 应,而铍和 镁与水 的 反 应十 分 缓慢[17]
钙的四种二卤化物都是已知的,[18]无水氯化钙
- 钙的碳酸盐在受热时(1173 K)
分解 [21]
虽然

同位 素
[编辑]46Ca
其它从35Ca
历史
[编辑]
虽然
维特鲁威
钙和
存在 和生 产
[编辑]
钙是
钙的
地球 化学 循环
[编辑]钙循环
3),沉降
实际
3):
3。该反应导致一
用途
[编辑]类似
很多钙
钙列于
食物 来 源
[编辑]對 人體 的 影響
[编辑]| 1–3岁 | 700 |
| 4–8岁 | 1000 |
| 9–18岁 | 1300 |
| 19–50岁 | 1000 |
| >51岁 | 1000 |
| 孕期 | 1000 |
| 1000 |

功 能
[编辑]钙是
结合
[编辑]钙离
营养
[编辑]钙是复合维生
骨骼 的 形成 和 血清 的 激 素 调节
[编辑]血清 钙水平 异常
[编辑]过量摄入钙会导致
长期
骨 病
[编辑]危险性
[编辑]| 钙 | |
|---|---|

| |
| 危险 | |
GHS危险
| |
| GHS |
Danger |
| H-术语 | H261 |
| P-术语 | P231+232 |
| NFPA 704 | |
参考 文献
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (
英 语). - ^ Krieck, Sven; Görls, Helmar; Westerhausen, Matthias. Mechanistic Elucidation of the Formation of the Inverse Ca(I) Sandwich Complex [(thf)3Ca(
μ -C6H3-1,3,5-Ph3)Ca(thf)3] and Stability of Aryl-Substituted Phenylcalcium Complexes. Journal of the American Chemical Society. 2010, 132 (35): 100818110534020. PMID 20718434. doi:10.1021/ja105534w. - ^ Weast, Robert. CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. 1984: E110. ISBN 0-8493-0464-4.
- ^ 柯
清水 編著 . 【新 世紀 化工 化學 辭典 】 The new century dictionary of chemical engineering and chemistry.第 一 版 .正 文書 局 . 2000: 355. ISBN 957-40-0253-5. - ^ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 Calcium. Linus Pauling Institute, Oregon State University, Corvallis, Oregon. 1 September 2017 [31 August 2019]. (
原始 内容 存 档于2020-06-16). - ^ 6.0 6.1 6.2 6.3 Calcium: Fact Sheet for Health Professionals. Office of Dietary Supplements, US National Institutes of Health. 9 July 2019 [31 August 2019]. (
原始 内容 存 档于2018-03-17). - ^ 7.0 7.1 7.2 7.3 Greenwood & Earnshaw 2016,
第 112-13頁 . - ^ Parish, R. V. The Metallic Elements. London: Longman. 1977: 34. ISBN 978-0-582-44278-8.
- ^ Ropp, Richard C. Encyclopedia of the Alkaline Earth Compounds. 2012: 12–15 [2022-07-09]. ISBN 978-0-444-59553-9. (
原始 内容 存 档于2021-04-27). - ^ 10.0 10.1 10.2 10.3 Hluchan & Pomerantz 2006,
第 484頁 . - ^ 11.0 11.1 C. R. Hammond The elements (pp. 4–35) in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 12.0 12.1 Hluchan & Pomerantz 2006,
第 483頁 . - ^
北京 师范大学 无机化学 教 研 室 等 .《无机化学 》下 册 ,第 651頁 . - ^ Greenwood & Earnshaw 2016,
第 119頁 . - ^ Nils-Gösta Vannerberg. F. Albert Cotton , 编. Peroxides, Superoxides, and Ozonides of the Metals of Groups Ia, IIa, and IIb. Progress in Inorganic Chemistry 4. International Journal of Quantum Chemistry. 01 Jan. 1962. doi:10.1002/9780470166055.ch3.
- ^ Greenwood & Earnshaw 2016,
第 121頁 . - ^
武 汉大学 等 校 .《无机化学 》下 册 ,第 796頁 . - ^ Greenwood & Earnshaw 2016,
第 117頁 . - ^
北京 师范大学 无机化学 教 研 室 等 .《无机化学 》下 册 ,第 662頁 . - ^ 20.0 20.1 Greenwood & Earnshaw 2016,
第 122-15頁 . - ^
北京 师范大学 无机化学 教 研 室 等 .《无机化学 》下 册 ,第 661頁 . - ^ Greenwood & Earnshaw 2016,
第 115頁 . - ^ Cynthia K. Schauer; Oren P. Anderson. Highly polydentate ligands. 5. Structures of alkaline-earth complexes of the calcium-selective ligand EGTA4- (H4EGTA = 3,12-Bis(carboxymethyl)-6,9-dioxa-3,12-diazatetradecanedioic acid). Inorganic Chemistry. 1988, 27 (18): 3118–3130. doi:10.1021/ic00291a015.
- ^ Harder, S.; Feil, F.; Knoll, K. Novel Calcium Half-Sandwich Complexes for the Living and Stereoselective Polymerization of Styrene. Angew. Chem. Int. Ed. 2001, 40 (22): 4261–64. PMID 29712082. doi:10.1002/1521-3773(20011119)40:22<4261::AID-ANIE4261>3.0.CO;2-J.
- ^ Crimmin, Mark R.; Casely, Ian J.; Hill, Michael S. Calcium-Mediated Intramolecular Hydroamination Catalysis. Journal of the American Chemical Society. 2005, 127 (7): 2042–43. PMID 15713071. doi:10.1021/ja043576n.
- ^ Jenter, Jelena; Köppe, Ralf; Roesky, Peter W. 2,5-Bis{N-(2,6-diisopropylphenyl)iminomethyl}pyrrolyl Complexes of the Heavy Alkaline Earth Metals: Synthesis, Structures, and Hydroamination Catalysis. Organometallics. 2011, 30 (6): 1404–13. doi:10.1021/om100937c.
- ^ Arrowsmith, Merle; Crimmin, Mark R.; Barrett, Anthony G. M.; Hill, Michael S.; Kociok-Köhn, Gabriele; Procopiou, Panayiotis A. Cation Charge Density and Precatalyst Selection in Group 2-Catalyzed Aminoalkene Hydroamination. Organometallics. 2011, 30 (6): 1493–1506. doi:10.1021/om101063m.
- ^ Penafiel, J.; Maron, L.; Harder, S. Early Main Group Metal Catalysis: How Important is the Metal?. Angew. Chem. Int. Ed. 2014, 54 (1): 201–06. PMID 25376952. doi:10.1002/anie.201408814.
- ^ 29.0 29.1 Greenwood & Earnshaw 2016,
第 136-37頁 . - ^ 30.0 30.1 Cameron, A. G. W. Abundance of the Elements in the Solar System (PDF). Space Science Reviews. 1973, 15 (1): 121–46 [2022-07-10]. Bibcode:1973SSRv...15..121C. S2CID 120201972. doi:10.1007/BF00172440. (
原始 内容 (PDF)存 档于2016-12-28). - ^ 31.0 31.1 31.2 Clayton, Donald. Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. 2003: 184–98. ISBN 9780521530835.
- ^ 32.0 32.1 32.2 Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. The NUBASE2016 evaluation of nuclear properties (PDF). Chinese Physics C. 2017, 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ Arnold, R.; et al. Measurement of the double-beta decay half-life and search for the neutrinoless double-beta decay of 48Ca with the NEMO-3 detector. Physical Review D. 2016, 93 (11): 112008. Bibcode:2016PhRvD..93k2008A. S2CID 55485404. arXiv:1604.01710
 . doi:10.1103/PhysRevD.93.112008.
. doi:10.1103/PhysRevD.93.112008.
- ^ 34.0 34.1 34.2 34.3 34.4 Greenwood & Earnshaw 2016,
第 108頁 . - ^ Miller, M. Michael. Commodity report:Lime (PDF). United States Geological Survey. [2012-03-06]. (
原始 内容 (PDF)存 档于2011-11-12). - ^ Garfinkel, Yosef. Burnt Lime Products and Social Implications in the Pre-Pottery Neolithic B Villages of the Near East. Paléorient. 1987, 13 (1): 69–76. JSTOR 41492234. doi:10.3406/paleo.1987.4417.
- ^ Williams, Richard. Lime Kilns and Lime Burning. 2004: 4. ISBN 978-0-7478-0596-0.[
失效 連結 ] - ^ Oates, J. A. H. Lime and Limestone: Chemistry and Technology, Production and Uses. 2008 [2022-07-11]. ISBN 978-3-527-61201-7. (
原始 内容 存 档于2022-07-18). - ^ 39.0 39.1 Weeks, Mary Elvira; Leichester, Henry M. Discovery of the Elements. Easton, PA: Journal of Chemical Education. 1968: 505–10. ISBN 978-0-7661-3872-8. LCCN 68-15217.
- ^ Davy, H. Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia. Philosophical Transactions of the Royal Society of London. 1808, 98: 333–70 [2022-07-11]. Bibcode:1808RSPT...98..333D. doi:10.1098/rstl.1808.0023
 . (
. (原始 内容 存 档于2021-03-22). - ^ 41.0 41.1 41.2 Greenwood & Earnshaw 2016,
第 110頁 . - ^ 42.0 42.1 Berner, Robert. The long-term carbon cycle, fossil fuels and atmospheric composition. Nature. 2003, 426 (6964): 323–26. Bibcode:2003Natur.426..323B. PMID 14628061. S2CID 4420185. doi:10.1038/nature02131.
- ^ Zeebe. Marine carbonate chemistry. National Council for Science and the Environment. 2006 [2010-03-13]. (
原始 内容 存 档于2011-09-03). - ^ Walker, James C. G.; Hays, P. B.; Kasting, J. F. A negative feedback mechanism for the long-term stabilization of Earth's surface temperature. Journal of Geophysical Research: Oceans. 1981-10-20, 86 (C10): 9776–82. Bibcode:1981JGR....86.9776W. ISSN 2156-2202. doi:10.1029/JC086iC10p09776 (
英 语). - ^
黄 淑 媛 ; 罗钢; 杨健;徐 刚军;周 军军; 郑庆. 氧含量 对超低 碳钢炼钢连铸过程夹杂物 演 变的影 响. 炼钢. 2021, 37 (4): 38–48. - ^ Lakshmi, C. S.; Manders, J. E.; Rice, D. M. Structure and properties of lead–calcium–tin alloys for battery grids. J. Power Sources. 1998, 73 (1): 23–29. ISSN 0378-7753. doi:10.1016/S0378-7753(98)00018-4.
- ^ 47.0 47.1 47.2 Hluchan & Pomerantz 2006,
第 485-87頁 . - ^ 48.0 48.1 Rumack BH. POISINDEX. Information System Micromedex, Inc., Englewood, CO, 2010; CCIS Volume 143. Hall AH and Rumack BH (Eds)
- ^ Skulan, J.; Depaolo, D. J.; Owens, T. L. Biological control of calcium isotopic abundances in the global calcium cycle. Geochimica et Cosmochimica Acta. June 1997, 61 (12): 2505–10. Bibcode:1997GeCoA..61.2505S. doi:10.1016/S0016-7037(97)00047-1.
- ^ 50.0 50.1 Skulan, J.; Bullen, T.; Anbar, A. D.; Puzas, J. E.; Shackelford, L.; Leblanc, A.; Smith, S. M. Natural calcium isotopic composition of urine as a marker of bone mineral balance. Clinical Chemistry. 2007, 53 (6): 1155–58. PMID 17463176. doi:10.1373/clinchem.2006.080143
 .
.
- ^ Fantle, M.; Depaolo, D. Ca isotopes in carbonate sediment and pore fluid from ODP Site 807A: The Ca2+(aq)–calcite equilibrium fractionation factor and calcite recrystallization rates in Pleistocene sediments. Geochim Cosmochim Acta. 2007, 71 (10): 2524–46. Bibcode:2007GeCoA..71.2524F. doi:10.1016/j.gca.2007.03.006.
- ^ Griffith, Elizabeth M.; Paytan, Adina; Caldeira, Ken; Bullen, Thomas; Thomas, Ellen. A Dynamic marine calcium cycle during the past 28 million years. Science. 2008, 322 (12): 1671–74. Bibcode:2008Sci...322.1671G. PMID 19074345. S2CID 206515318. doi:10.1126/science.1163614.
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. ch 6. Tolerable Upper Intake Levels. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. 2011: 403–56 [2022-07-12]. ISBN 978-0-309-16394-1. PMID 21796828. doi:10.17226/13050. (
原始 内容 存 档于2019-08-31). - ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006 [2022-07-12], (
原始 内容 (PDF)存 档于2016-03-16) - ^ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D Calcium; Ross, A. C.; Taylor, C. L.; Yaktine, A. L.; Del Valle, H. B. ch. 5. Dietary Reference Intakes. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C: National Academies Press. 2011: 345–402 [2022-07-13]. ISBN 978-0-309-16394-1. PMID 21796828. doi:10.17226/13050. (
原始 内容 存 档于2019-12-07). - ^ Balk EM, Adam GP, Langberg VN, Earley A, Clark P, Ebeling PR, Mithal A, Rizzoli R, Zerbini CA, Pierroz DD, Dawson-Hughes B. Global dietary calcium intake among adults: a systematic review. Osteoporosis International. December 2017, 28 (12): 3315–24. PMC 5684325
 . PMID 29026938. doi:10.1007/s00198-017-4230-x.
. PMID 29026938. doi:10.1007/s00198-017-4230-x.
- ^ Sosa Torres, Martha; Kroneck, Peter M.H; "Introduction: From Rocks to Living Cells" pp. 1–32 in "Metals, Microbes and Minerals: The Biogeochemical Side of Life" (2021) pp. xiv + 341. Walter de Gruyter, Berlin. Editors Kroneck, Peter M.H. and Sosa Torres, Martha. doi:10.1515/9783110589771-001
- ^ 59.0 59.1 59.2 59.3 59.4 59.5 Hluchan & Pomerantz 2006,
第 489-94頁 . - ^ 60.0 60.1 Hluchan & Pomerantz 2006,
第 487-89頁 .
扩展阅读
[编辑]- Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (
英 语). - Hluchan, Stephen E.; Pomerantz, Kenneth, Calcium and Calcium Alloys, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, 2006-04-15, doi:10.1002/14356007.a04_515.pub2
北京 师范大学 无机化学 教 研 室 等 (编). 《无机化学 》下 册 .北京 :高等 教育 出版 社 . 2003. ISBN 978-7-04-011583-3.武 汉大学 等 校 (编). 《无机化学 》下 册 .北京 :高等 教育 出版 社 . 2011. ISBN 978-7-04-004880-3.
外部 連結
[编辑]元素 钙在洛 斯阿拉 莫斯国家 实验室 的 介 紹(英文 )- EnvironmentalChemistry.com —— 钙(
英文 ) 元素 钙在 The Periodic Table of Videos(諾 丁 漢 大學 )的 介 紹(英文 )元素 钙在Peter van der Krogt elements site的 介 紹(英文 )- WebElements.com – 钙(
英文 )
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||