DNAナノテクノロジー
DNAナノテクノロジー(
DNAナノテクノロジーの
基本 的 なコンセプト
[核酸 の特性
[ナノテクノロジーは
下位 分野
[
構造 DNAナノテクノロジー
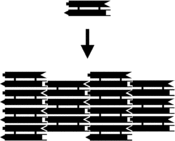
[拡張 格子
[
2
DXアレイから
DNAによって3
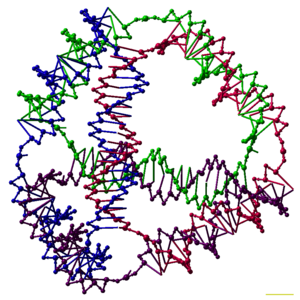
離散 構造
[テンプレートによるアセンブリ
[動的 DNAナノテクノロジー
[
ナノメカニカル素子
[ナノロボットの
DNAウォーカーは
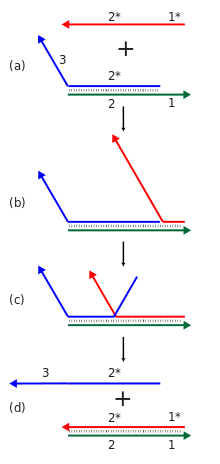
鎖 置換 カスケード
[
応用
[DNAナノテクノロジーは、
DNAナノテクノロジーは
オーフス
ナノ
DNAナノテクノロジーの
設計
[DNAナノ
構造 設計
[- タイルベースの
構造 - このアプローチではターゲット
構造 を小 さなユニットに分割 する。それぞれのユニットに含 まれる鎖 どうしは強 く結合 しているが、ユニット間 の相互 作用 はそれより弱 い。周期 格子 の作製 に用 いられることが多 いが、アルゴリズミック・セルフアセンブリにも応用 できるためDNAコンピューティングのプラットフォームになりうる。1990年代 半 ばから2000年代 半 ばまで主要 な戦略 だったが、DNAオリガミの方法 論 が発展 するとその地位 を失 った[23][79]。 折 りたたみ構造 - タイルベースのアプローチに
代 わるもので、1本 の長 い鎖 を折 りたたんでナノ構造 を作 る。長 い鎖 の各部 が互 いに結合 するように設計 することで折 り畳 みを行 うか、あるいは短 い「ステープル」鎖 が留 め金 の役割 を果 たす。後者 の方法 はDNAオリガミと呼 ばれており、2次元 ・3次元 のナノスケール形状 を作製 することができる(離散 構造 節 参照 )[27][30]。 動的 アセンブリ最終 的 な生成 物 だけでなく、反応 機構 の中間 ステップすべてを設計 することでDNAセルフアセンブリの動力 学 を直接 制御 するアプローチ。ヘアピン構造 を持 つ出発 物質 が決 まった順序 でカスケード反応 を起 こして最終 的 な配 座 にアセンブルする(鎖 置換 カスケード節 参照 )。このアプローチには一定 温度 で等温 的 に進行 する利点 があり、アセンブリをトリガーして正 しく構造 形成 を行 うために高温 の熱 アニーリングステップを必要 とする熱 力学 的 アプローチとは対照 的 である[27][56]。
塩基 配列 の設計
[いずれかのアプローチによって
作製 方法
[
ターゲット
歴史
[| エッシャー ( |
|---|
| ネイドリアン・シーマンはDNA3 |
DNAナノテクノロジーの
1991
2000
2006
DNAナノテクノロジーは
関連 項目
[- International Society for Nanoscale Science, Computation, and Engineering
核酸 のシミュレーションソフトウェアの比較 - DNAの
分子 モデル - ナノバイオテクノロジー
脚注
[- ^ a b DNA polyhedra: Goodman, Russel P.; Schaap, Iwan A. T.; Tardin, C. F.; Erben, Christof M.; Berry, Richard M.; Schmidt, C.F.; Turberfield, Andrew J. (9 December 2005). “Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication”. Science 310 (5754): 1661–1665. Bibcode: 2005Sci...310.1661G. doi:10.1126/science.1120367. PMID 16339440.
- ^ Background: Pelesko, John A. (2007). Self-assembly: the science of things that put themselves together. New York: Chapman & Hall/CRC. pp. 5, 7. ISBN 978-1-58488-687-7
- ^
村田 智 「DNAナノテクノロジーへの招待 」『現代 化学 』第 541巻 、2016年 、47-51頁 、NAID 40020759717。 - ^ a b c d e Overview: Seeman, Nadrian C. (2010). “Nanomaterials based on DNA”. Annual Review of Biochemistry 79: 65–87. doi:10.1146/annurev-biochem-060308-102244. PMC 3454582. PMID 20222824.
- ^ Background: Long, Eric C. (1996). “Fundamentals of nucleic acids”. In Hecht, Sidney M. Bioorganic chemistry: nucleic acids. New York: Oxford University Press. pp. 4–10. ISBN 978-0-19-508467-2
- ^ a b c d e Overview: Seeman, Nadrian C. (June 2004). “Nanotechnology and the double helix”. Scientific American 290 (6): 64–75. Bibcode: 2004SciAm.290f..64S. doi:10.1038/scientificamerican0604-64. PMID 15195395.
- ^ RNA nanotechnology: Chworos, Arkadiusz; Severcan, Isil; Koyfman, Alexey Y.; Weinkam, Patrick; Oroudjev, Emin; Hansma, Helen G.; Jaeger, Luc (2004). “Building Programmable Jigsaw Puzzles with RNA”. Science 306 (5704): 2068–2072. Bibcode: 2004Sci...306.2068C. doi:10.1126/science.1104686. PMID 15604402.
- ^ RNA nanotechnology: Guo, Peixuan (2010). “The Emerging Field of RNA Nanotechnology”. Nature Nanotechnology 5 (12): 833–842. Bibcode: 2010NatNa...5..833G. doi:10.1038/nnano.2010.231. PMC 3149862. PMID 21102465.
- ^ a b c Overview: Mao, Chengde (December 2004). “The emergence of complexity: lessons from DNA”. PLoS Biology 2 (12): 2036–2038. doi:10.1371/journal.pbio.0020431. PMC 535573. PMID 15597116.
- ^ a b c d Dynamic DNA nanotechnology: Zhang, D. Y.; Seelig, G. (February 2011). “Dynamic DNA nanotechnology using strand-displacement reactions”. Nature Chemistry 3 (2): 103–113. Bibcode: 2011NatCh...3..103Z. doi:10.1038/nchem.957. PMID 21258382.
- ^ a b c d e Structural DNA nanotechnology: Seeman, Nadrian C. (November 2007). “An overview of structural DNA nanotechnology”. Molecular Biotechnology 37 (3): 246–257. doi:10.1007/s12033-007-0059-4. PMC 3479651. PMID 17952671.
- ^ Dynamic DNA nanotechnology: Lu, Y.; Liu, J. (December 2006). “Functional DNA nanotechnology: Emerging applications of DNAzymes and aptamers”. Current Opinion in Biotechnology 17 (6): 580–588. doi:10.1016/j.copbio.2006.10.004. PMID 17056247.
- ^ Other arrays: Strong, Michael (March 2004). “Protein Nanomachines”. PLoS Biology 2 (3): e73. doi:10.1371/journal.pbio.0020073. PMC 368168. PMID 15024422.
- ^ Yan, H.; Park, S. H.; Finkelstein, G.; Reif, J. H.; Labean, T. H. (26 September 2003). “DNA-templated self-assembly of protein arrays and highly conductive nanowires”. Science 301 (5641): 1882–1884. Bibcode: 2003Sci...301.1882Y. doi:10.1126/science.1089389. PMID 14512621.
- ^ a b Algorithmic self-assembly: Rothemund, Paul W. K.; Papadakis, Nick; Winfree, Erik (December 2004). “Algorithmic self-assembly of DNA Sierpinski triangles”. PLoS Biology 2 (12): 2041–2053. doi:10.1371/journal.pbio.0020424. PMC 534809. PMID 15583715.
- ^ DX arrays: Winfree, Erik; Liu, Furong; Wenzler, Lisa A.; Seeman, Nadrian C. (6 August 1998). “Design and self-assembly of two-dimensional DNA crystals”. Nature 394 (6693): 529–544. Bibcode: 1998Natur.394..539W. doi:10.1038/28998. PMID 9707114.
- ^ DX arrays: Liu, Furong; Sha, Ruojie; Seeman, Nadrian C. (10 February 1999). “Modifying the surface features of two-dimensional DNA crystals”. Journal of the American Chemical Society 121 (5): 917–922. doi:10.1021/ja982824a.
- ^ Other arrays: Mao, Chengde; Sun, Weiqiong; Seeman, Nadrian C. (16 June 1999). “Designed two-dimensional DNA Holliday junction arrays visualized by atomic force microscopy”. Journal of the American Chemical Society 121 (23): 5437–5443. doi:10.1021/ja9900398.
- ^ Other arrays: Constantinou, Pamela E.; Wang, Tong; Kopatsch, Jens; Israel, Lisa B.; Zhang, Xiaoping; Ding, Baoquan; Sherman, William B.; Wang, Xing et al. (21 September 2006). “Double cohesion in structural DNA nanotechnology”. Organic and Biomolecular Chemistry 4 (18): 3414–3419. doi:10.1039/b605212f. PMC 3491902. PMID 17036134.
- ^ Other arrays: Mathieu, Frederick; Liao, Shiping; Kopatsch, Jens; Wang, Tong; Mao, Chengde; Seeman, Nadrian C. (April 2005). “Six-helix bundles designed from DNA”. Nano Letters 5 (4): 661–665. Bibcode: 2005NanoL...5..661M. doi:10.1021/nl050084f. PMC 3464188. PMID 15826105.
- ^ a b c History: Seeman, Nadrian (9 June 2010). “Structural DNA nanotechnology: growing along with Nano Letters”. Nano Letters 10 (6): 1971–1978. Bibcode: 2010NanoL..10.1971S. doi:10.1021/nl101262u. PMC 2901229. PMID 20486672.
- ^ Algorithmic self-assembly: Barish, Robert D.; Rothemund, Paul W. K.; Winfree, Erik (December 2005). “Two computational primitives for algorithmic self-assembly: copying and counting”. Nano Letters 5 (12): 2586–2592. Bibcode: 2005NanoL...5.2586B. doi:10.1021/nl052038l. PMID 16351220.
- ^ a b c d Design: Feldkamp, U.; Niemeyer, C. M. (13 March 2006). “Rational design of DNA nanoarchitectures”. Angewandte Chemie International Edition 45 (12): 1856–1876. doi:10.1002/anie.200502358. PMID 16470892.
- ^ DNA nanotubes: Rothemund, Paul W. K.; Ekani-Nkodo, Axel; Papadakis, Nick; Kumar, Ashish; Fygenson, Deborah Kuchnir; Winfree, Erik (22 December 2004). “Design and Characterization of Programmable DNA Nanotubes”. Journal of the American Chemical Society 126 (50): 16344–16352. doi:10.1021/ja044319l. PMID 15600335.
- ^ DNA nanotubes: Yin, P.; Hariadi, R. F.; Sahu, S.; Choi, H. M. T.; Park, S. H.; Labean, T. H.; Reif, J. H. (8 August 2008). “Programming DNA Tube Circumferences”. Science 321 (5890): 824–826. Bibcode: 2008Sci...321..824Y. doi:10.1126/science.1157312. PMID 18687961.
- ^ Three-dimensional arrays: Zheng, Jianping; Birktoft, Jens J.; Chen, Yi; Wang, Tong; Sha, Ruojie; Constantinou, Pamela E.; Ginell, Stephan L.; Mao, Chengde et al. (3 September 2009). “From molecular to macroscopic via the rational design of a self-assembled 3D DNA crystal”. Nature 461 (7260): 74–77. Bibcode: 2009Natur.461...74Z. doi:10.1038/nature08274. PMC 2764300. PMID 19727196.
- ^ a b c d e f g h i Overview: Pinheiro, A. V.; Han, D.; Shih, W. M.; Yan, H. (December 2011). “Challenges and opportunities for structural DNA nanotechnology”. Nature Nanotechnology 6 (12): 763–772. Bibcode: 2011NatNa...6..763P. doi:10.1038/nnano.2011.187. PMC 3334823. PMID 22056726.
- ^ DNA polyhedra: Zhang, Yuwen; Seeman, Nadrian C. (1 March 1994). “Construction of a DNA-truncated octahedron”. Journal of the American Chemical Society 116 (5): 1661–1669. doi:10.1021/ja00084a006.
- ^ DNA polyhedra: Shih, William M.; Quispe, Joel D.; Joyce, Gerald F. (12 February 2004). “A 1.7-kilobase single-stranded DNA that folds into a nanoscale octahedron”. Nature 427 (6975): 618–621. Bibcode: 2004Natur.427..618S. doi:10.1038/nature02307. PMID 14961116.
- ^ a b c DNA origami: Rothemund, Paul W. K. (16 March 2006). “Folding DNA to create nanoscale shapes and patterns”. Nature 440 (7082): 297–302. Bibcode: 2006Natur.440..297R. doi:10.1038/nature04586. PMID 16541064.
- ^ Tikhomirov, Grigory; Petersen, Philip; Qian, Lulu (December 2017). “Fractal assembly of micrometre-scale DNA origami arrays with arbitrary patterns”. Nature 552 (7683): 67–71. Bibcode: 2017Natur.552...67T. doi:10.1038/nature24655. ISSN 1476-4687. PMID 29219965.
- ^ a b DNA origami: Douglas, Shawn M.; Dietz, Hendrik; Liedl, Tim; Högberg, Björn; Graf, Franziska; Shih, William M. (21 May 2009). “Self-assembly of DNA into nanoscale three-dimensional shapes”. Nature 459 (7245): 414–418. Bibcode: 2009Natur.459..414D. doi:10.1038/nature08016. PMC 2688462. PMID 19458720.
- ^ a b DNA boxes: Andersen, Ebbe S.; Dong, Mingdong; Nielsen, Morten M.; Jahn, Kasper; Subramani, Ramesh; Mamdouh, Wael; Golas, Monika M.; Sander, Bjoern et al. (7 May 2009). “Self-assembly of a nanoscale DNA box with a controllable lid”. Nature 459 (7243): 73–76. Bibcode: 2009Natur.459...73A. doi:10.1038/nature07971. PMID 19424153.
- ^ DNA boxes: Ke, Yonggang; Sharma, Jaswinder; Liu, Minghui; Jahn, Kasper; Liu, Yan; Yan, Hao (10 June 2009). “Scaffolded DNA origami of a DNA tetrahedron molecular container”. Nano Letters 9 (6): 2445–2447. Bibcode: 2009NanoL...9.2445K. doi:10.1021/nl901165f. PMID 19419184.
- ^ Overview: Endo, M.; Sugiyama, H. (12 October 2009). “Chemical approaches to DNA nanotechnology”. ChemBioChem 10 (15): 2420–2443. doi:10.1002/cbic.200900286. PMID 19714700.
- ^ Nanoarchitecture: Zheng, Jiwen; Constantinou, Pamela E.; Micheel, Christine; Alivisatos, A. Paul; Kiehl, Richard A.; Seeman Nadrian C. (July 2006). “2D Nanoparticle Arrays Show the Organizational Power of Robust DNA Motifs”. Nano Letters 6 (7): 1502–1504. Bibcode: 2006NanoL...6.1502Z. doi:10.1021/nl060994c. PMC 3465979. PMID 16834438.
- ^ Nanoarchitecture: Park, Sung Ha; Pistol, Constantin; Ahn, Sang Jung; Reif, John H.; Lebeck, Alvin R.; Dwyer, Chris; LaBean, Thomas H. (October 2006). “Finite-size, fully addressable DNA tile lattices formed by hierarchical assembly procedures”. Angewandte Chemie 118 (40): 749–753. doi:10.1002/ange.200690141.
- ^ Nanoarchitecture: Cohen, Justin D.; Sadowski, John P.; Dervan, Peter B. (22 October 2007). “Addressing single molecules on DNA nanostructures”. Angewandte Chemie International Edition 46 (42): 7956–7959. doi:10.1002/anie.200702767. PMID 17763481.
- ^ Nanoarchitecture: Maune, Hareem T.; Han, Si-Ping; Barish, Robert D.; Bockrath, Marc; Goddard III, William A.; Rothemund, Paul W. K.; Winfree, Erik (January 2009). “Self-assembly of carbon nanotubes into two-dimensional geometries using DNA origami templates”. Nature Nanotechnology 5 (1): 61–66. Bibcode: 2010NatNa...5...61M. doi:10.1038/nnano.2009.311. PMID 19898497.
- ^ Nanoarchitecture: Liu, J.; Geng, Y.; Pound, E.; Gyawali, S.; Ashton, J. R.; Hickey, J.; Woolley, A. T.; Harb, J. N. (22 March 2011). “Metallization of branched DNA origami for nanoelectronic circuit fabrication”. ACS Nano 5 (3): 2240–2247. doi:10.1021/nn1035075. PMID 21323323.
- ^ Nanoarchitecture: Deng, Z.; Mao, C. (6 August 2004). “Molecular lithography with DNA nanostructures”. Angewandte Chemie International Edition 43 (31): 4068–4070. doi:10.1002/anie.200460257. PMID 15300697.
- ^ a b c d DNA machines: Bath, Jonathan; Turberfield, Andrew J. (May 2007). “DNA nanomachines”. Nature Nanotechnology 2 (5): 275–284. Bibcode: 2007NatNa...2..275B. doi:10.1038/nnano.2007.104. PMID 18654284.
- ^ DNA machines: Mao, Chengde; Sun, Weiqiong; Shen, Zhiyong; Seeman, Nadrian C. (14 January 1999). “A DNA nanomechanical device based on the B-Z transition”. Nature 397 (6715): 144–146. Bibcode: 1999Natur.397..144M. doi:10.1038/16437. PMID 9923675.
- ^ DNA machines: Yurke, Bernard; Turberfield, Andrew J.; Mills, Allen P., Jr; Simmel, Friedrich C.; Neumann, Jennifer L. (10 August 2000). “A DNA-fuelled molecular machine made of DNA”. Nature 406 (6796): 605–609. Bibcode: 2000Natur.406..605Y. doi:10.1038/35020524. PMID 10949296.
- ^ DNA machines: Yan, Hao; Zhang, Xiaoping; Shen, Zhiyong; Seeman, Nadrian C. (3 January 2002). “A robust DNA mechanical device controlled by hybridization topology”. Nature 415 (6867): 62–65. Bibcode: 2002Natur.415...62Y. doi:10.1038/415062a. PMID 11780115.
- ^ DNA machines: Feng, L.; Park, S. H.; Reif, J. H.; Yan, H. (22 September 2003). “A two-state DNA lattice switched by DNA nanoactuator”. Angewandte Chemie 115 (36): 4478–4482. doi:10.1002/ange.200351818.
- ^ DNA machines: Goodman, R. P.; Heilemann, M.; Doose, S. R.; Erben, C. M.; Kapanidis, A. N.; Turberfield, A. J. (February 2008). “Reconfigurable, braced, three-dimensional DNA nanostructures”. Nature Nanotechnology 3 (2): 93–96. Bibcode: 2008NatNa...3...93G. doi:10.1038/nnano.2008.3. PMID 18654468.
- ^ Applications: Douglas, Shawn M.; Bachelet, Ido; Church, George M. (17 February 2012). “A logic-gated nanorobot for targeted transport of molecular payloads”. Science 335 (6070): 831–834. Bibcode: 2012Sci...335..831D. doi:10.1126/science.1214081. PMID 22344439.
- ^ DNA walkers: Shin, Jong-Shik; Pierce, Niles A. (8 September 2004). “A synthetic DNA walker for molecular transport”. Journal of the American Chemical Society 126 (35): 10834–10835. doi:10.1021/ja047543j. PMID 15339155.
- ^ DNA walkers: Sherman, William B.; Seeman, Nadrian C. (July 2004). “A precisely controlled DNA biped walking device”. Nano Letters 4 (7): 1203–1207. Bibcode: 2004NanoL...4.1203S. doi:10.1021/nl049527q.
- ^ DNA walkers: Tian, Ye; He, Yu; Chen, Yi; Yin, Peng; Mao, Chengde (11 July 2005). “A DNAzyme that walks processively and autonomously along a one-dimensional track”. Angewandte Chemie 117 (28): 4429–4432. doi:10.1002/ange.200500703.
- ^ DNA walkers: Bath, Jonathan; Green, Simon J.; Turberfield, Andrew J. (11 July 2005). “A free-running DNA motor powered by a nicking enzyme”. Angewandte Chemie International Edition 44 (28): 4358–4361. doi:10.1002/anie.200501262. PMID 15959864.
- ^ Functional DNA walkers: Lund, Kyle; Manzo, Anthony J.; Dabby, Nadine; Michelotti, Nicole; Johnson-Buck, Alexander; Nangreave, Jeanette; Taylor, Steven; Pei, Renjun et al. (13 May 2010). “Molecular robots guided by prescriptive landscapes”. Nature 465 (7295): 206–210. Bibcode: 2010Natur.465..206L. doi:10.1038/nature09012. PMC 2907518. PMID 20463735.
- ^ Functional DNA walkers: He, Yu; Liu, David R. (November 2010). “Autonomous multistep organic synthesis in a single isothermal solution mediated by a DNA walker”. Nature Nanotechnology 5 (11): 778–782. Bibcode: 2010NatNa...5..778H. doi:10.1038/nnano.2010.190. PMC 2974042. PMID 20935654.
- ^ Pan, J; Li, F; Cha, TG; Chen, H; Choi, JH (2015). “Recent progress on DNA based walkers”. Current Opinion in Biotechnology 34: 56–64. doi:10.1016/j.copbio.2014.11.017. PMID 25498478.
- ^ a b c Kinetic assembly: Yin, Peng; Choi, Harry M. T.; Calvert, Colby R.; Pierce, Niles A. (17 January 2008). “Programming biomolecular self-assembly pathways”. Nature 451 (7176): 318–322. Bibcode: 2008Natur.451..318Y. doi:10.1038/nature06451. PMID 18202654.
- ^ Fuzzy and Boolean logic gates based on DNA: Zadegan, R. M.; Jepsen, M. D. E.; Hildebrandt, L. L.; Birkedal, V.; Kjems, J. R. (2015). “Construction of a Fuzzy and Boolean Logic Gates Based on DNA”. Small 11 (15): 1811–7. doi:10.1002/smll.201402755. PMID 25565140.
- ^ Strand displacement cascades: Seelig, G.; Soloveichik, D.; Zhang, D. Y.; Winfree, E. (8 December 2006). “Enzyme-free nucleic acid logic circuits”. Science 314 (5805): 1585–1588. Bibcode: 2006Sci...314.1585S. doi:10.1126/science.1132493. PMID 17158324.
- ^ Strand displacement cascades: Qian, Lulu; Winfree, Erik (3 June 2011). “Scaling up digital circuit computation with DNA strand displacement cascades”. Science 332 (6034): 1196–1201. Bibcode: 2011Sci...332.1196Q. doi:10.1126/science.1200520. PMID 21636773.
- ^ a b c d e History/applications: Service, Robert F. (3 June 2011). “DNA nanotechnology grows up”. Science 332 (6034): 1140–1143. doi:10.1126/science.332.6034.1140. PMID 21636754.
- ^ Applications: Rietman, Edward A. (2001). Molecular engineering of nanosystems. Springer. pp. 209–212. ISBN 978-0-387-98988-4 2011
年 4月 17日 閲覧 。 - ^ M. Zadegan, Reza; et, al. (2012). “Construction of a 4 Zeptoliters Switchable 3D DNA Box Origami”. ACS Nano 6 (11): 10050–10053. doi:10.1021/nn303767b. PMID 23030709.
- ^ Applications: Jungmann, Ralf; Renner, Stephan; Simmel, Friedrich C. (March 2008). “From DNA nanotechnology to synthetic biology”. HFSP Journal 2 (2): 99–109. doi:10.2976/1.2896331. PMC 2645571. PMID 19404476.
- ^ Lovy, Howard (2011
年 7月 5日 ). “DNA cages can unleash meds inside cells”. fiercedrugdelivery.com. 2013年 9月 22日 閲覧 。 - ^ Walsh, Anthony; Yin, Hai; Erben, Christoph; Wood, Matthew; Turberfield, Andrew (2011). “DNA Cage Delivery to Mammalian Cells”. ACS Nano 5 (7): 5427–5432. doi:10.1021/nn2005574. PMID 21696187.
- ^ Trafton, Anne (2012
年 6月 4日 ). “Researchers achieve RNA interference, in a lighter package”. MIT News. 2013年 9月 22日 閲覧 。 - ^ Lee, Hyukjin; Lytton-Jean, Abigail; Chen, Yi; Love, Kevin; Park, Angela; Karagiannis, Emmanouil; Sehgal, Alfica; Querbes, William et al. (2012). “Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery”. Nature Nanotechnology 7 (6): 389–393. Bibcode: 2012NatNa...7..389L. doi:10.1038/NNANO.2012.73. PMC 3898745. PMID 22659608.
- ^ Kim, Kyoung-Ran; Kim, Da-Rae; Lee, Taemin; Yhee, Ji Young; Kim, Byeong-Su; Kwon, Ick Chan; Ahn, Dae-Ro (2013). “Drug delivery by a self-assembled DNA tetrahedron for overcoming drug resistance in breast cancer cells” (
英語 ). Chemical Communications 49 (20): 2010–2. doi:10.1039/c3cc38693g. ISSN 1359-7345. PMID 23380739. - ^ DNA ion channels: Langecker, M; Arnaut, V; Martin, TG; List, J; Renner, S; Mayer, M; Dietz, H; Simmel, FC (16 November 2012). “Synthetic lipid membrane channels formed by designed DNA nanostructures”. Science 338 (6109): 932–936. doi:10.1126/science.1225624. PMC 3716461. PMID 23161995.
- ^ a b DNA ion channels: Göpfrich, K; Li, CY; Mames, I; Bhamidimarri, SP; Ricci, M; Yoo, J; Mames, A; Ohmann, A et al. (13 July 2016). “Ion Channels Made from a Single Membrane-Spanning DNA Duplex”. Nano Letters 16 (7): 4665–4669. doi:10.1021/acs.nanolett.6b02039. PMC 4948918. PMID 27324157.
- ^ DNA ion channels: Burns, JR; Stulz, E; Howorka, S (12 June 2013). “Self-assembled DNA nanopores that span lipid bilayers”. Nano Letters 13 (6): 2351–2356. doi:10.1021/nl304147f. PMID 23611515.
- ^ DNA ion channels: Burns, JR; Göpfrich, K; Wood, JW; Thacker, VV; Stulz, E; Keyser, UF; Howorka, S (11 November 2013). “Lipid-bilayer-spanning DNA nanopores with a bifunctional porphyrin anchor”. Angewandte Chemie (International Ed. In English) 52 (46): 12069–12072. doi:10.1002/anie.201305765. PMC 4016739. PMID 24014236.
- ^ DNA ion channels: Seifert, A; Göpfrich, K; Burns, JR; Fertig, N; Keyser, UF; Howorka, S (24 February 2015). “Bilayer-spanning DNA nanopores with voltage-switching between open and closed state”. ACS Nano 9 (2): 1117–1126. doi:10.1021/nn5039433. PMC 4508203. PMID 25338165.
- ^ DNA ion channels: Göpfrich, Kerstin; Zettl, Thomas; Meijering, Anna E. C.; Hernández-Ainsa, Silvia; Kocabey, Samet; Liedl, Tim; Keyser, Ulrich F. (8 April 2015). “DNA-Tile Structures Induce Ionic Currents through Lipid Membranes”. Nano Letters 15 (5): 3134–3138. doi:10.1021/acs.nanolett.5b00189. PMID 25816075.
- ^ DNA ion channels: Burns, Jonathan R.; Seifert, Astrid; Fertig, Niels; Howorka, Stefan (11 January 2016). “A biomimetic DNA-based channel for the ligand-controlled transport of charged molecular cargo across a biological membrane”. Nature Nanotechnology 11 (2): 152–156. doi:10.1038/nnano.2015.279. PMID 26751170.
- ^ DNA ion channels: Göpfrich, Kerstin; Li, Chen-Yu; Ricci, Maria; Bhamidimarri, Satya Prathyusha; Yoo, Jejoong; Gyenes, Bertalan; Ohmann, Alexander; Winterhalter, Mathias et al. (23 August 2016). “Large-Conductance Transmembrane Porin Made from DNA Origami”. ACS Nano 10 (9): 8207–8214. doi:10.1021/acsnano.6b03759. PMC 5043419. PMID 27504755.
- ^ DNA scramblase: Ohmann, Alexander; Li, Chen-Yu; Maffeo, Christopher; Al Nahas, Kareem; Baumann, Kevin N.; Göpfrich, Kerstin; Yoo, Jejoong; Keyser, Ulrich F. et al. (21 June 2018). “A synthetic enzyme built from DNA flips 107 lipids per second in biological membranes”. Nature Communications 9 (1): 2426. doi:10.1038/s41467-018-04821-5. PMC 6013447. PMID 29930243.
- ^ a b c Design: Brenneman, Arwen; Condon, Anne (25 September 2002). “Strand design for biomolecular computation”. Theoretical Computer Science 287: 39–58. doi:10.1016/S0304-3975(02)00135-4.
- ^ Overview: Lin, Chenxiang; Liu, Yan; Rinker, Sherri; Yan, Hao (11 August 2006). “DNA tile based self-assembly: building complex nanoarchitectures”. ChemPhysChem 7 (8): 1641–1647. doi:10.1002/cphc.200600260. PMID 16832805.
- ^ a b c Design: Dirks, Robert M.; Lin, Milo; Winfree, Erik; Pierce, Niles A. (15 February 2004). “Paradigms for computational nucleic acid design”. Nucleic Acids Research 32 (4): 1392–1403. doi:10.1093/nar/gkh291. PMC 390280. PMID 14990744.
- ^ Methods: Ellington, A.; Pollard, J. D. (1 May 2001). “Synthesis and purification of oligonucleotides”. Current Protocols in Molecular Biology. Chapter 2. Unit2.11. doi:10.1002/0471142727.mb0211s42. ISBN 978-0471142720. PMID 18265179
- ^ Methods: Ellington, A.; Pollard, J. D. (1 May 2001). “Purification of oligonucleotides using denaturing polyacrylamide gel electrophoresis”. Current Protocols in Molecular Biology. Chapter 2. Unit2.12. doi:10.1002/0471142727.mb0212s42. ISBN 978-0471142720. PMID 18265180
- ^ Methods: Gallagher, S. R.; Desjardins, P. (1 July 2011). “Quantitation of nucleic acids and proteins”. Current Protocols Essential Laboratory Techniques. doi:10.1002/9780470089941.et0202s5. ISBN 978-0470089934
- ^ Methods: Chory, J.; Pollard, J. D. (1 May 2001). “Separation of small DNA fragments by conventional gel electrophoresis”. Current Protocols in Molecular Biology. Chapter 2. Unit2.7. doi:10.1002/0471142727.mb0207s47. ISBN 978-0471142720. PMID 18265187
- ^ Methods: Walter, N. G. (1 February 2003). “Probing RNA structural dynamics and function by fluorescence resonance energy transfer (FRET)”. Current Protocols in Nucleic Acid Chemistry. Chapter 11. 11.10.1–11.10.23. doi:10.1002/0471142700.nc1110s11. ISBN 978-0471142706. PMID 18428904
- ^ Methods: Lin, C.; Ke, Y.; Chhabra, R.; Sharma, J.; Liu, Y.; Yan, H. (2011). “Synthesis and Characterization of Self-Assembled DNA Nanostructures”. In Zuccheri, G. and Samorì, B. DNA Nanotechnology: Methods and Protocols. Methods in Molecular Biology. 749. pp. 1–11. doi:10.1007/978-1-61779-142-0_1. ISBN 978-1-61779-141-3. PMID 21674361
- ^ Methods: Bloomfield, Victor A.; Crothers, Donald M.; Tinoco, Jr., Ignacio (2000). Nucleic acids: structures, properties, and functions. Sausalito, Calif: University Science Books. pp. 84–86, 396–407. ISBN 978-0-935702-49-1
- ^ a b c History: Pelesko, John A. (2007). Self-assembly: the science of things that put themselves together. New York: Chapman & Hall/CRC. pp. 201, 242, 259. ISBN 978-1-58488-687-7
- ^ History: See “Current crystallization protocol”. Nadrian Seeman Lab. 2019
年 10月 2日 閲覧 。 for a statement of the problem, and “DNA cages containing oriented guests”. Nadrian Seeman Laboratory. 2019年 10月 2日 閲覧 。 for the proposed solution. - ^ a b DNA origami: Rothemund, Paul W. K. (2006). “Scaffolded DNA origami: from generalized multicrossovers to polygonal networks”. In Chen, Junghuei; Jonoska, Natasha; Rozenberg, Grzegorz. Nanotechnology: science and computation. Natural Computing Series. New York: Springer. pp. 3–21. doi:10.1007/3-540-30296-4_1. ISBN 978-3-540-30295-7
- ^ Nanoarchitecture: Robinson, Bruche H.; Seeman, Nadrian C. (August 1987). “The design of a biochip: a self-assembling molecular-scale memory device”. Protein Engineering 1 (4): 295–300. doi:10.1093/protein/1.4.295. PMID 3508280.
- ^ Nanoarchitecture: Xiao, Shoujun; Liu, Furong; Rosen, Abbey E.; Hainfeld, James F.; Seeman, Nadrian C.; Musier-Forsyth, Karin; Kiehl, Richard A. (August 2002). “Selfassembly of metallic nanoparticle arrays by DNA scaffolding”. Journal of Nanoparticle Research 4 (4): 313–317. Bibcode: 2002JNR.....4..313X. doi:10.1023/A:1021145208328.
- ^ Junghuei Chen; Nadrian C. Seeman (1991). “Synthesis from DNA of a molecule with the connectivity of a cube”. Nature 350: 631-633. doi:10.1038/350631a0.
- ^ History: Hopkin, Karen (August 2011). “Profile: 3-D seer”. The Scientist 2011
年 8月 8日 閲覧 。.
関連 文献
[- Seeman, Nadrian C. (June 2004). “Nanotechnology and the double helix”. Scientific American 290 (6): 64–75. Bibcode: 2004SciAm.290f..64S. doi:10.1038/scientificamerican0604-64. PMID 15195395.—
分野 の創設 者 による一般 向 けの記事 。 - Seeman, Nadrian C. (9 June 2010). “Structural DNA nanotechnology: growing along with Nano Letters”. Nano Letters 10 (6): 1971–1978. Bibcode: 2010NanoL..10.1971S. doi:10.1021/nl101262u. PMC 2901229. PMID 20486672.— 2001–2010
年 の期間 に報告 された研究 結果 の総説 。 - Seeman, Nadrian C. (2010). “Nanomaterials based on DNA”. Annual Review of Biochemistry 79: 65–87. doi:10.1146/annurev-biochem-060308-102244. PMC 3454582. PMID 20222824.—
古今 の研究 を紹介 する包括 的 な総説 。 - Service, Robert F. (3 June 2011). “DNA nanotechnology grows up”. Science 332 (6034): 1140–1143. doi:10.1126/science.332.6034.1140. PMID 21636754..—
分野 の歴史 と応用 展開 を中心 とするニュース記事 。 - Zadegan, Reza M.; Norton, Michael L. (June 2012). “Structural DNA Nanotechnology: From Design to Applications”. Int. J. Mol. Sci. 13 (6): 7149–7162. doi:10.3390/ijms13067149. PMC 3397516. PMID 22837684.—
近年 の包括 的 な総説 。 村田 智 他 「【連載 】DNAナノテクノロジー ―構造 を作 り,計算 し,ナノロボットを動 かす」『現代 化学 』第 541-549号 、2016年 4月 ―12月。—初心者 向 けの解説 記事 。
- Bath, Jonathan; Turberfield, Andrew J. (5 May 2007). “DNA nanomachines”. Nature Nanotechnology 2 (5): 275–284. Bibcode: 2007NatNa...2..275B. doi:10.1038/nnano.2007.104. PMID 18654284.—
核酸 ナノメカニカル素子 のレビュー論文 。 - Feldkamp, Udo; Niemeyer, Christof M. (13 March 2006). “Rational design of DNA nanoarchitectures”. Angewandte Chemie International Edition 45 (12): 1856–76. doi:10.1002/anie.200502358. PMID 16470892.—
二 次 的 な構造 デザインの観点 から書 かれた総説 。 - Lin, Chenxiang; Liu, Yan; Rinker, Sherri; Yan, Hao (11 August 2006). “DNA tile based self-assembly: building complex nanoarchitectures”. ChemPhysChem 7 (8): 1641–1647. doi:10.1002/cphc.200600260. PMID 16832805.—タイルベースのアセンブリに
注目 した短 いレビュー。 - Zhang, David Yu; Seelig, Georg (February 2011). “Dynamic DNA nanotechnology using strand-displacement reactions”. Nature Chemistry 3 (2): 103–113. Bibcode: 2011NatCh...3..103Z. doi:10.1038/nchem.957. PMID 21258382.—
鎖 置換 機構 を利用 したDNA系 のレビュー。
外部 リンク
[- What is Bionanotechnology? — DNAナノテクノロジーを
紹介 する動画 (英語 )。