フェロセン
| フェロセン | |
|---|---|

|
|

| |
bis( | |
フェロセン ビス(シクロペンタジエニル) | |
| CAS |
102-54-5 |
| PubChem | 11985121 |
| ChEBI | |
| |
| C10H10Fe | |
| モル |
186.04 g/mol |
| ショウノウ | |
| 1.49 g/cm3 | |
|
174 °C | |
|
249 °C | |
| GHSピクトグラム |   
|
| GHSシグナルワード | Warning |
| Hフレーズ | H228, H302, H411 |
| Pフレーズ | P210, P240, P241, P264, P270, P273, P280, P301+312, P330, P370+378, P391, P501[1] |
| NFPA 704 | |
| コバルトセン ニッケロセン クロモセン ビス(ベンゼン)クロム | |
フェロセン (
フェロセンは
歴史 [編集 ]

フェロセンは
1952
ミュンヘン
シクロペンタジエニルナトリウムと
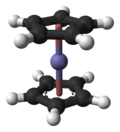
構造 と結合 [編集 ]
5
2つのCp
フェロセンの
物理 的 性質 [編集 ]
フェロセンは
フェロセンは
| 1 | 10 | 100 | |
|---|---|---|---|
| 298 | 323 | 353 |
化学 的 性質 [編集 ]
求 電子 剤 との反応 性 [編集 ]
フェロセンは
リン
リチオ化 [編集 ]
フェロセンはブチルリチウムなどにより
酸化 還元 特性 [編集 ]
シクロペンタジエニル
フェロセンは FeCl3 により
フェロセンとその誘導体 の応用 [編集 ]
フェロセン
燃料 への添加 [編集 ]
フェロセンとその
医療 [編集 ]
ある
物質 化学 [編集 ]
配 位 子 [編集 ]
キラルなフェロセニルホスフィン
その他 [編集 ]
誘導体 [編集 ]
また Fe(
脚注 [編集 ]
- ^ Ferrocene 1GHS Classification
- ^ R. Dagani (3 December 2001). "Fifty Years of Ferrocene Chemistry" (
要 登録 ). Chemical and Engineering News, 79 (49): 37-38.記事 - ^ a b Kealy, T. J.; Pauson, P. L. (1951). “A New Type of Organo-Iron Compound”. Nature 168 (4285): 1039. Bibcode: 1951Natur.168.1039K. doi:10.1038/1681039b0.
- ^ G. Wilkinson, M. Rosenblum, M. C. Whiting, R. B. Woodward (1952). "The Structure of Iron Bis-Cyclopentadienyl". Journal of the American Chemical Society 74: 2125 - 2126. DOI:10.1021/ja01128a527
- ^ E. O. Fischer, W. Pfab (1952). "Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels". Z. Naturforsch. B 7: 377 - 379.
- ^ J. Dunitz, L. Orgel, A. Rich (1956). "The crystal structure of ferrocene". Acta Crystallographica 9: 373–5. DOI:10.1107/S0365110X56001091
- ^ Pierre Laszlo, Roald Hoffmann, (2000). "Ferrocene: Ironclad History or Rashomon Tale?". Angewandte Chemie International Edition 39: 123 - 124.
記事 - ^ Haaland, A.; Nilsson, J. E. (1968). “The Determination of Barriers to Internal Rotation by Means of Electron Diffraction. Ferrocene and Ruthenocene”. Acta Chem. Scand. 22: 2653–2670. doi:10.3891/acta.chem.scand.22-2653.
- ^ Coriani, Sonia; Haaland, Arne; Helgaker, Trygve; Jørgensen, Poul (2006). “The Equilibrium Structure of Ferrocene”. ChemPhysChem 7: 245–249. doi:10.1002/cphc.200500339.
- ^ Abel, E. W.; Long, N. J.; Orrell, K. G.; Osborne, A. G.; Sik, V. (1991). “Dynamic NMR studies of ring rotation in substituted ferrocenes and ruthenocenes”. J. Org. Chem. 403: 195–208. doi:10.1016/0022-328X(91)83100-I.
- ^ Monte, M. J. S.; Santos, L. M. N. B. F.; Fulem, M.; Fonseca, J. M. S. & Sousa, C. A. D., (2006). "New static apparatus and vapor pressure of reference materials: Naphthalene, benzoic acid, benzophenone, and ferrocene", J. Chem. Eng. Data, 51, 757-766
- ^ G.R. Knox, P.L. Pauson and D. Willison (1992). "Ferrocene derivatives. 27. Ferrocenyldimethylphosphine". Organometallics 11 (8): 2930 - 2933. DOI:10.1021/om00044a038.
- ^ G.P. Sollott, H.E. Mertwoy, S. Portnoy and J.L. Snead, J. Org. Chem., 1963, 28, 1090 - 1092. DOI:10.1021/jo01039a055.
- ^ M.R.StJ. Foreman, A.M.Z. Slawin and J.D. Woollins, J. Chem. Soc., Dalton Trans., 1996, 3653 - 3658. DOI:10.1039/DT9960003653.
- ^ Ron Rulkens, Derek P. Gates, David Balaishis, John K. Pudelski, Douglas F. McIntosh, Alan J. Lough, and Ian Manners, J. Am. Chem. Soc., 1997, 119, 10976. DOI:10.1021/ja972043u
- ^ Paloma Gómez-Elipe, Rui Resendes, Peter M. Macdonald, and Ian Manners, J. Am. Chem. Soc., 1998, 120, 8348. DOI:10.1021/ja981429h.
- ^ Timothy J. Peckham, Jason A. Massey, Charles H. Honeyman, and Ian Manners, Macromolecules, 1999, 32, 2830. DOI:10.1021/ma981329w
- ^ N. G. Connelly, W. E. Geiger (1996). "Chemical Redox Agents for Organometallic Chemistry". Chemical Reviews 96: 877-910. DOI:10.1021/cr940053x
- ^ Application of fuel additives (International Conference on Automotive Technology, Istanbul, 26/11/2004) Archived 2006
年 5月 5日 , at the Wayback Machine. - ^
アメリカ合衆国 特許 第 4,104,036号 - ^ Top S; Vessières A; Leclercq G; Quivy J; Tang J; Vaissermann J; Huché M; Jaouen G, (2003). Chemistry 9(21): 5223-36
記事 - ^ Ron Dagani (16 Sep 2002). "The Bio Side of Organometallics". Chemical and Engineering News 80 (37): 23-29.
記事 . - ^ S. Top, B. Dauer, J. Vaissermann and G. Jaouen (1997). "Facile route to ferrocifen, 1-[4-(2-dimethylaminoethoxy)]-1-(phenyl-2-ferrocenyl-but-1-ene), first organometallic analogue of tamoxifen, by the McMurry reaction". Journal of Organometallic Chemistry 541: 355-361. DOI:10.1016/S0022-328X(97)00086-7.
- ^ S. Top, A. Vessières, G. Leclercq, J. Quivy, J. Tang, J. Vaissermann, M. Huché and G. Jaouen (2003). "Synthesis, Biochemical Properties and Molecular Modelling Studies of Organometallic Specific Estrogen Receptor Modulators (SERMs), the Ferrocifens and Hydroxyferrocifens: Evidence for an Antiproliferative Effect of Hydroxyferrocifens on both Hormone-Dependent and Hormone-Independent Breast Cancer Cell Lines". Chemistry, a European Journal 9: 5223-5236. DOI:10.1002/chem.200305024.
- ^ Liu, Wan-yi; Xu, Qi-hai; Ma, Yong-xiang; Liang, Yong-min; Dong, Ning-li; Guan, De-peng,J. Organomet. Chem., 2001, 625, 128 - 132 DOI:10.1016/S0022-328X(00)00927-X
- ^ B.R. Waldbaum and R.C. Kerber, Inorg. Chim. Acta, 1999, 291, 109 - 126. DOI:/10.1016/S0020-1693(99)00123-1
- ^ J. Zakrzewski and C. Gianotti, J. Organomet. Chem., 1990, 388, 175 - 180. DOI:10.1016/0022-328X(90)85359-7
- ^ A. Efraty, N. Jubran and A. Goldman, Inorg. Chem., 1982, 21, 868 - 873. DOI:10.1021/ic00133a006
- ^ Y. Yu, A.D. Bond, P. W. Leonard, K. P. C. Vollhardt, G. D. Whitener (2006). "Syntheses, Structures, and Reactivity of Radial Oligocyclopentadienyl Metal Complexes: Penta(ferrocenyl)cyclopentadienyl and Congeners". Angewandte Chemie International Edition 45 (11): 1794 - 1799. DOI:10.1002/anie.200504047.
参考 文献 [編集 ]
- フェロセンの
発見 (構造 は間違 っている)
- Kealy, T. J., Pauson, P. L. (1951). "A New Type of Organo-iron Compound". Nature 168: 1039-40. DOI:10.1038/1681039b0.
- Miller, S. A., Tebboth, J. A., Tremaine, J. F. (1952). "114. Dicyclopentadienyliron". Journal of the Chemical Society: 632-635. DOI:10.1039/JR9520000632
正確 な構造 の報告
- Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. (1952). "The Structure of Iron Bis-Cyclopentadienyl". Journal of the American Chemical Society 74: 2125-2126. DOI:10.1021/ja01128a527.
- Fischer, E. O., Pfab, W. (1952). "Cyclopentadien-Metallkomplexe, ein neuer typ metallorganischer Verbindungen". Zeitschrift für Naturforschung B, 7: 377-379.
- その
他
- Dunitz, J. D., Orgel, L. E. (1953). "Bis-Cyclopentadienyl - A Molecular Sandwich". Nature 171: 121-122. DOI:10.1038/171121a0
- Pauson, P. L. (2001). "Ferrocene-how it all began". Journal of Organometallic Chemistry: 637-639. DOI:10.1016/S0022-328X(01)01126-3.
- Gerard Jaouen (ed.) (2006). Bioorganometallics: Biomolecules, Labeling, Medicine. Weinheim: Wiley-VCH. ISBN 978-3-527-30990-0.(
生体 内 におけるフェロセンおよびその誘導体 の役割 について論 じている)
外部 リンク[編集 ]
国際 化学 物質 安全 性 カード フェロセン (ICSC:1512)日本語 版 (国立 医薬品 食品 衛生 研究所 による),英語 版

