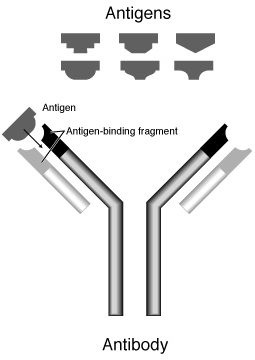
免疫 めんえき 抗体 こうたい 色 いろ 薄 うす 部分 ぶぶん 軽 けい 鎖 くさり 先端 せんたん 黒 くろ 部分 ぶぶん 可変 かへん 部 ぶ 適合 てきごう 抗原 こうげん 可変 かへん 部 ぶ 特異 とくい 的 てき 結合 けつごう 抗体 こうたい ( こうたい 、( 英 えい antibody )は、白血球 はっけっきゅう 一 ひと リンパ球 だま の一種 いっしゅ B細胞 さいぼう の産 さん 生 せい 糖 とう 分子 ぶんし 免疫 めんえき ( めんえきグロブリン 、( 血漿 けっしょう 中 ちゅう γ がんま (英語 えいご 版 ばん Ig (アイジー)とも。獲得 かくとく 免疫 めんえき 系 けい 液 えき 性 せい 免疫 めんえき 特定 とくてい タンパク質 たんぱくしつ 分子 ぶんし 抗原 こうげん 認識 にんしき 排除 はいじょ 働 はたら 担 にな 抗体 こうたい 主 おも 血液 けつえき 中 なか 体液 たいえき 中 なか 存在 そんざい
B細胞 さいぼう 抗原 こうげん 応 おう 分化 ぶんか 抗体 こうたい 産 さん 生 せい 一度 いちど 分化 ぶんか 細胞 さいぼう 大量 たいりょう 抗体 こうたい 迅速 じんそく 産 さん 生 せい 抗原 こうげん 除去 じょきょ 生態 せいたい 防御 ぼうぎょ [1]
抗体 こうたい 抗原 こうげん 結合 けつごう 抗原 こうげん 抗体 こうたい 複 ふく 合体 がったい 好 こう 中 ちゅう 球 だま マクロファージ といった食 しょく 細胞 さいぼう 認識 にんしき 貪食 どんしょく 体内 たいない 除去 じょきょ 働 はたら 球 だま 免疫 めんえき 細胞 さいぼう 結合 けつごう 免疫 めんえき 反応 はんのう 引 ひ 起 お 働 はたら 通 つう 脊椎動物 せきついどうぶつ 感染 かんせん 防御 ぼうぎょ 機構 きこう 重要 じゅうよう 役割 やくわり 担 にな 無 む 脊椎動物 せきついどうぶつ 抗体 こうたい 産 さん 生 せい
抗体 こうたい パパイン により、2つのFab領域 りょういき 領域 りょういき 分断 ぶんだん 抗体 こうたい ペプシン により、F(ab')2 領域 りょういき 多数 たすう 断片 だんぺん 分断 ぶんだん 軽 けい 鎖 くさり 重 じゅう 鎖 くさり [ 編集 へんしゅう ] すべての抗体 こうたい 基本 きほん 的 てき 同 おな 構造 こうぞう 持 も 字 じ 型 がた 本 ほん 鎖 くさり 構造 こうぞう 軽 けい 鎖 くさり 重 じゅう 鎖 くさり 鎖 くさり 本 ほん 基本 きほん 構造 こうぞう [注釈 ちゅうしゃく 軽 けい 鎖 くさり 鎖 くさり λ らむだ 鎖 くさり κ かっぱ 鎖 くさり 種類 しゅるい 免疫 めんえき 持 も 分子 ぶんし 量 りょう 約 やく 共通 きょうつう 重 じゅう 鎖 くさり 鎖 くさり γ がんま 鎖 くさり μ みゅー 鎖 くさり α あるふぁ 鎖 くさり δ でるた 鎖 くさり ε いぷしろん 鎖 くさり 構造 こうぞう 異 こと 種類 しゅるい 重 じゅう 鎖 くさり 違 ちが 免疫 めんえき 種類 しゅるい アイソタイプ 呼 よ 変 か 分子 ぶんし 量 りょう 軽 けい 鎖 くさり 重 じゅう 鎖 くさり ジスルフィド結合 けつごう (SS結合 けつごう 結 むす ヘテロダイマー を形成 けいせい 左右 さゆう 結合 けつごう 結合 けつごう 字 じ 型 がた 形成 けいせい
2本 ほん 軽 けい 鎖 くさり 同士 どうし 本 ほん 重 じゅう 鎖 くさり 同士 どうし 全 まった 同一 どういつ 鎖 くさり
Fc領域 りょういき 領域 りょういき [ 編集 へんしゅう ] "Y"字 じ 下 した 半分 はんぶん 縦 たて 棒 ぼう 部分 ぶぶん 場所 ばしょ Fc領域 りょういき (Fragment, crystallizable) と呼 よ 左右 さゆう 重 じゅう 鎖 くさり 白血球 はっけっきゅう 食 しょく 細胞 さいぼう 領域 りょういき 結合 けつごう 受容 じゅよう 体 たい 受容 じゅよう 体 たい 持 も 受容 じゅよう 体 たい 介 かい 抗原 こうげん 結合 けつごう 抗体 こうたい 認識 にんしき 抗原 こうげん 貪食 どんしょく オプソニン作用 さよう )。その他 た 領域 りょういき 補 ほ 体 たい 活性 かっせい 化 か 抗体 こうたい 依存 いぞん 性 せい 細胞 さいぼう 傷害 しょうがい 作用 さよう 英 えい Antibody Dependent Cellular Cytotoxicity 、ADCC)など、免疫 めんえき 反応 はんのう 媒介 ばいかい 領域 りょういき 抗体 こうたい 抗原 こうげん 結合 けつごう 後 のち 反応 はんのう 惹起 じゃっき 機能 きのう 免疫 めんえき 機能 きのう 免疫 めんえき 種類 しゅるい 異 こと
"Y"字 じ 上 うえ 半分 はんぶん 字 じ 部分 ぶぶん Fab領域 りょういき (Fragment,antigen binding) と呼 よ 領域 りょういき 先端 せんたん 部分 ぶぶん 抗原 こうげん 結合 けつごう 本 ほん 軽 けい 鎖 くさり 本 ほん 重 じゅう 鎖 くさり 重 じゅう 鎖 くさり 領域 りょういき 領域 りょういき 部 ぶ 左右 さゆう 重 じゅう 鎖 くさり 部 ぶ 結合 けつごう パパイヤ に含 ふく 分解 ぶんかい 酵素 こうそ パパイン はこのヒンジ部 ぶ 分解 ぶんかい 領域 りょういき 切断 せつだん [3] 分解 ぶんかい 酵素 こうそ ペプシン はヒンジ部 ぶ 結合 けつごう 側 がわ 切断 せつだん 大 おお 個 こ 2 を1つと、多数 たすう 小 ちい 断片 だんぺん 生成 せいせい [4] 断片 だんぺん H 3領域 りょういき 相当 そうとう 最 もっと 大 おお 断片 だんぺん 呼 よ 2 は、ジスルフィド結合 けつごう 部 ぶ 含 ふく 構造 こうぞう 大 おお 区別 くべつ 2 は抗原 こうげん 結合 けつごう 領域 りょういき 持 も 後 ご 免疫 めんえき 反応 はんのう 引 ひ 起 お 利用 りよう 抗原 こうげん 標識 ひょうしき 用 もち
免疫 めんえき 基本 きほん 構造 こうぞう 領域 りょういき 領域 りょういき 重 じゅう 鎖 くさり 端 はし 側 がわ H 、CH 1、ヒンジ部 ぶ H 2、CH 3), (4) 軽 けい 鎖 くさり 端 はし 側 がわ L 、CL ), (5) 抗原 こうげん 結合 けつごう 部位 ぶい 部 ぶ 定常 ていじょう 領域 りょういき 可変 かへん 領域 りょういき [ 編集 へんしゅう ] Fab領域 りょういき 先端 せんたん 近 ちか 半分 はんぶん 多様 たよう 抗原 こうげん 結合 けつごう アミノ酸 あみのさん 配列 はいれつ 多彩 たさい 変化 へんか 領域 りょういき 先端 せんたん 近 ちか 半分 はんぶん 可変 かへん 領域 りょういき V領域 りょういき )といい、軽 けい 鎖 くさり 可変 かへん 領域 りょういき VL 領域 りょういき 、重 じゅう 鎖 くさり 可変 かへん 領域 りょういき VH 領域 りょういき と呼 よ 領域 りょういき 以外 いがい 領域 りょういき 領域 りょういき 比較的 ひかくてき 変化 へんか 少 すく 領域 りょういき 定常 ていじょう 領域 りょういき C領域 りょういき )と呼 よ 軽 けい 鎖 くさり 定常 ていじょう 領域 りょういき CL 領域 りょういき と呼 よ 重 じゅう 鎖 くさり 定常 ていじょう 領域 りょういき CH 領域 りょういき と呼 よ H 領域 りょういき H 1〜CH 3の3つに分 わ 重 じゅう 鎖 くさり 領域 りょういき H 領域 りょういき H 1からなり、重 じゅう 鎖 くさり 領域 りょういき H 2とCH 3からなる。ヒンジ部 ぶ H 1とCH 2の間 あいだ 位置 いち
相補 そうほ 性 せい 決定 けってい 領域 りょういき 領域 りょういき [ 編集 へんしゅう ] 可変 かへん 領域 りょういき 直接 ちょくせつ 抗原 こうげん 接触 せっしょく 領域 りょういき 特 とく 変化 へんか 大 おお 超 ちょう 可変 かへん 領域 りょういき 相補 そうほ 性 せい 決定 けってい 領域 りょういき CDR ) と呼 よ 以外 いがい 比較的 ひかくてき 変異 へんい 少 すく 部分 ぶぶん フレームワーク領域 りょういき (framework region: FR ) と呼 よ 軽 けい 鎖 くさり 重 じゅう 鎖 くさり 可変 かへん 領域 りょういき 取 と 囲 かこ 存在 そんざい
抗体 こうたい 定常 ていじょう 領域 りょういき 構造 こうぞう 違 ちが クラス (アイソタイプ )に分 わ 多 おお 哺乳類 ほにゅうるい 定常 ていじょう 領域 りょういき 構造 こうぞう 違 ちが 種類 しゅるい 免疫 めんえき 分類 ぶんるい 抗体 こうたい 免疫 めんえき 大 おお 生理 せいり 活性 かっせい 異 こと 例 たと 粘膜 ねんまく 分泌 ぶんぴつ 型 がた 分子 ぶんし 肥満 ひまん 細胞 さいぼう 結合 けつごう アレルギー 反応 はんのう 引 ひ 起 お 場合 ばあい 少 すこ 構造 こうぞう 異 こと
また、免疫 めんえき 血 ち 中 ちゅう 粘膜 ねんまく 分泌 ぶんぴつ 型 がた 他 ほか B細胞 さいぼう の細胞 さいぼう 表面 ひょうめん 結合 けつごう 型 かた 膜 まく 型 がた
ヒト免疫 めんえき 分類 ぶんるい [ 編集 へんしゅう ] ヒト免疫 めんえき 構造 こうぞう 重 じゅう 鎖 くさり 定常 ていじょう 領域 りょういき 違 ちが γ がんま 鎖 くさり μ みゅー 鎖 くさり α あるふぁ 鎖 くさり δ でるた 鎖 くさり ε いぷしろん 鎖 くさり 分 わ 違 ちが 種類 しゅるい 免疫 めんえき 形成 けいせい 分泌 ぶんぴつ 型 がた 免疫 めんえき 他 ほか 細胞 さいぼう 表面 ひょうめん 結合 けつごう 分泌 ぶんぴつ 型 がた 免疫 めんえき 細胞 さいぼう 表面 ひょうめん 接着 せっちゃく 細胞 さいぼう 膜 まく 貫通 かんつう 部分 ぶぶん B細胞 さいぼう 受容 じゅよう 体 たい (B cell receptor; BCR) と呼 よ 本 ほん 重 じゅう 鎖 くさり 本 ほん 軽 けい 鎖 くさり 持 も 細胞 さいぼう 膜 まく 貫通 かんつう 部分 ぶぶん α あるふぁ β べーた 二 に 量 りょう 体 からだ 持 も 違 ちが 免疫 めんえき 持 も 機能 きのう 異 こと
IgG
免疫 めんえき 免疫 めんえき 占 し 血漿 けっしょう 中 ちゅう 最 もっと 多 おお 単 たん 量 りょう 体 たい 抗体 こうたい 軽 けい 鎖 くさり 本 ほん 重 じゅう 鎖 くさり 本 ほん 本 ほん 鎖 くさり 構造 こうぞう 分子 ぶんし 量 りょう 約 やく 領域 りょういき 領域 りょういき 部 ぶ 長 なが 分子 ぶんし 量 りょう 大 おお 程度 ていど 程度 ていど 程度 ていど 程度 ていど 占 し 血管 けっかん 内外 ないがい 平均 へいきん 分布 ぶんぷ IgM
免疫 めんえき 免疫 めんえき 約 やく 占 し 基本 きほん 本 ほん 鎖 くさり 構造 こうぞう 結合 けつごう 五 ご 量 りょう 体 たい 抗体 こうたい 分子 ぶんし 量 りょう 通常 つうじょう 血 ち 中 ちゅう 存在 そんざい 感染 かんせん 微生物 びせいぶつ 対 たい 最初 さいしょ 産 さん 生 む 初期 しょき 免疫 めんえき 司 つかさど 免疫 めんえき 分子 ぶんし 量 りょう 大 おお マクログロブリン とも呼 よ マクロ は、「大 おお 意味 いみ IgA
免疫 めんえき 免疫 めんえき 占 し 分子 ぶんし 量 りょう 分泌 ぶんぴつ 型 がた 結合 けつごう 二 に 量 りょう 体 たい 抗体 こうたい 主 おも 分類 ぶんるい 血清 けっせい 鼻汁 はなしる 唾液 だえき 母乳 ぼにゅう 精液 せいえき 腸 ちょう 液 えき 多 おお 存在 そんざい [5] IgD
免疫 めんえき 免疫 めんえき 以下 いか 単 たん 量 りょう 体 たい 抗体 こうたい 細胞 さいぼう 表面 ひょうめん 存在 そんざい 抗体 こうたい 産 さん 生 せい 誘導 ゆうどう 関与 かんよ IgE
免疫 めんえき 免疫 めんえき 以下 いか 極 ごく 微量 びりょう 存在 そんざい 単 たん 量 りょう 体 たい 抗体 こうたい 抗原 こうげん 反応 はんのう ヒスタミン の分泌 ぶんぴつ 起 お [6] 寄生虫 きせいちゅう 対 たい 免疫 めんえき 反応 はんのう 関与 かんよ 考 かんが 寄生虫 きせいちゅう 稀 まれ 先進 せんしん 国 こく 特 とく 気管支 きかんし 喘息 ぜんそく アレルギー に大 おお 関与 かんよ 肥満 ひまん 細胞 さいぼう 言 い マスト細胞 さいぼう の表面 ひょうめん ε いぷしろん 受容 じゅよう 体 たい 常駐 じょうちゅう 抗原 こうげん 結合 けつごう 反応 はんのう 細胞 さいぼう 活性 かっせい 化 か ヒスタミン などの分泌 ぶんぴつ 物 ぶつ 細胞 さいぼう 放出 ほうしゅつ [6] 好 こう 塩基 えんき 球 だま 存在 そんざい その他 た 生物 せいぶつ 分類 ぶんるい [ 編集 へんしゅう ] 免疫 めんえき 無 む 脊椎動物 せきついどうぶつ 見 み 軟骨 なんこつ 魚類 ぎょるい 以降 いこう 脊椎動物 せきついどうぶつ 見 み 生物 せいぶつ 複数 ふくすう 免疫 めんえき 持 も 種類 しゅるい 綱 つな 違 ちが 見 み [7] 脊椎動物 せきついどうぶつ 共通 きょうつう 見 み
軟骨 なんこつ 魚類 ぎょるい IgMの他 ほか 呼 よ 持 も
硬骨魚 こうこつぎょ 類 るい IgMとIgD、IgT(IgZ)を持 も
ハイギョ IgM, IgW, IgW (long) を持 も
爬虫類 はちゅうるい IgMの他 ほか 呼 よ 持 も [8]
両生類 りょうせいるい アフリカツメガエル )IgMの他 ほか 呼 よ 持 も
鳥類 ちょうるい ニワトリ )IgM、IgA、IgYを持 も
哺乳類 ほにゅうるい IgM、IgD、IgG、IgA、IgEの5種類 しゅるい 持 も また、同 おな 哺乳類 ほにゅうるい 種類 しゅるい 種 たね 違 ちが 見 み 例 たと 種類 しゅるい 対 たい 種類 しゅるい
関連 かんれん 話題 わだい 軟骨 なんこつ 魚類 ぎょるい 硬骨魚 こうこつぎょ 類 るい クラススイッチ を起 お [8] 生物 せいぶつ 免疫 めんえき 抗体 こうたい 起 お 両生類 りょうせいるい 爬虫類 はちゅうるい 鳥類 ちょうるい 哺乳類 ほにゅうるい
両生類 りょうせいるい 爬虫類 はちゅうるい 共通 きょうつう 見 み [8] 哺乳類 ほにゅうるい 鳥類 ちょうるい 共通 きょうつう 見 み [8] 哺乳類 ほにゅうるい 見 み [8]
抗体 こうたい 血液 けつえき 中 ちゅう 体液 たいえき 中 ちゅう 遊離 ゆうり 型 がた 存在 そんざい B細胞 さいぼう 表面 ひょうめん 上 じょう B細胞 さいぼう 受容 じゅよう 体 たい として存在 そんざい 特定 とくてい 抗原 こうげん 結合 けつごう 機能 きのう 抗体 こうたい 最 もっと 重要 じゅうよう 機能 きのう
抗体 こうたい 細菌 さいきん 微生物 びせいぶつ 毒素 どくそ 抗原 こうげん 結合 けつごう 抗原 こうげん 抗体 こうたい 結合 けつごう 凝集 ぎょうしゅう 反応 はんのう 免疫 めんえき 沈降 ちんこう 凝集 ぎょうしゅう 抗原 こうげん 抗体 こうたい 複 ふく 合体 がったい マクロファージ やその他 た 食 しょく 細胞 さいぼう 認識 にんしき 貪食 どんしょく 際 さい 抗体 こうたい 領域 りょういき 等 とう 認識 にんしき 貪食 どんしょく 役割 やくわり オプソニン作用 さよう )。そしてマクロファージに貪食 どんしょく 抗原 こうげん 内 ない 分解 ぶんかい 細胞 さいぼう 複 ふく 合体 がったい 提示 ていじ 免疫 めんえき 反応 はんのう 抗体 こうたい 補 ほ 体 たい 活性 かっせい 化 か 作用 さよう 通 とお 免疫 めんえき 反応 はんのう 抗体 こうたい 中 なか 結合 けつごう 微生物 びせいぶつ 感染 かんせん 力 りょく 低下 ていか 毒性 どくせい 減少 げんしょう 働 はたら 中和 ちゅうわ 作用 さよう 機構 きこう 抗体 こうたい 体内 たいない 侵入 しんにゅう 細菌 さいきん 微生物 びせいぶつ 毒素 どくそ 微生物 びせいぶつ 感染 かんせん 細胞 さいぼう 認識 にんしき 体内 たいない 排除 はいじょ
B細胞 さいぼう 表面 ひょうめん 存在 そんざい 細胞 さいぼう 抗原 こうげん 認識 にんしき 受容 じゅよう 体 たい 働 はたら 特異 とくい 的 てき 抗原 こうげん 結合 けつごう 抗体 こうたい 産 さん 生 せい 細胞 さいぼう 形質 けいしつ 細胞 さいぼう 体 からだ 細胞 さいぼう 超 ちょう 変異 へんい 組 く 換 か 等 とう 経 へ 後 のち 抗原 こうげん 対 たい 親和 しんわ 性 せい 高 たか 抗体 こうたい 産 さん 生 せい 細胞 さいぼう 記憶 きおく 細胞 さいぼう 分化 ぶんか 引 ひ 起 お 抗体 こうたい 産 さん 生 せい 細胞 さいぼう 同 おな 抗原 こうげん 特異 とくい 性 せい 持 も 抗体 こうたい 産 さん 生 せい
抗原 こうげん 抗体 こうたい 結合 けつごう [ 編集 へんしゅう ] 抗体 こうたい 抗原 こうげん 結合 けつごう 際 さい 抗原 こうげん 一部分 いちぶぶん エピトープ )のみを認識 にんしき 結合 けつごう 抗体 こうたい 立体 りったい 構造 こうぞう 厳密 げんみつ 認識 にんしき 結合 けつごう アミノ酸 あみのさん 配列 はいれつ 違 ちが 荷電 かでん 差 さ 光学 こうがく 異性 いせい 体 たい 立体 りったい 異性 いせい 体 たい 違 ちが 結合 けつごう 結合 けつごう 抗 こう 体側 たいそく 部分 ぶぶん パラトープ という。エピトープとパラトープの間 あいだ 水素 すいそ 結合 けつごう 静電気 せいでんき 力 りょく ファンデルワールス力 りょく 、疎水 そすい 結合 けつごう 引力 いんりょく 力 ちから 安定 あんてい 結合 けつごう 間 あいだ 結合 けつごう 力 りょく アフィニティ affinity という。
ただし、抗体 こうたい 基本 きほん 本 ほん 鎖 くさり 構造 こうぞう 抗原 こうげん 結合 けつごう 部位 ぶい カ所 かしょ 五 ご 量 りょう 体 たい 二 に 量 りょう 体 からだ 形成 けいせい 多 おお 抗原 こうげん 認識 にんしき 部位 ぶい 持 も 抗原 こうげん 複数 ふくすう 抗体 こうたい 抗原 こうげん 抗体 こうたい 所 しょ 結合 けつごう 価 か 同時 どうじ 複数 ふくすう 所 しょ 認識 にんしき 多 た 価 あたい 抗原 こうげん 抗体 こうたい 結合 けつごう 結合 けつごう 力 りょく 総和 そうわ アビディティ avidity と呼 よ 多 た 価 あたい 結合 けつごう 際 さい 結合 けつごう 力 りょく 相乗 そうじょう 的 てき 働 はたら 高 たか
マクロファージや好 こう 中 ちゅう 球 だま 食 しょく 細胞 さいぼう 細菌 さいきん 死 し 細胞 さいぼう 結合 けつごう 能力 のうりょく 持 も 細菌 さいきん 死 し 細胞 さいぼう 抗体 こうたい 補 ほ 体 たい 結合 けつごう 食 しょく 細胞 さいぼう 補 ほ 体 たい 受容 じゅよう 体 たい 受容 じゅよう 体 たい 介 かい 結合 けつごう 食 しょく 作用 さよう 促進 そくしん 作用 さよう
補 ほ 体 たい 活性 かっせい 化 か 機能 きのう [ 編集 へんしゅう ] 抗体 こうたい 補 ほ 体 たい 古典 こてん 経路 けいろ 補 ほ 体 たい 活性 かっせい 化 か 抗体 こうたい 結合 けつごう 細菌 さいきん 補 ほ 体 たい 結合 けつごう 細菌 さいきん 細胞 さいぼう 膜 まく 破壊 はかい 溶菌 ようきん 作用 さよう 食 しょく 細胞 さいぼう 抗原 こうげん 食 しょく 作用 さよう 促進 そくしん 機能 きのう 補 ほ 体 たい 活性 かっせい 化 か 能 のう 低 ひく 機能 きのう
細菌 さいきん 微生物 びせいぶつ 虫 むし 毒素 どくそ 自 みずか 構造 こうぞう 一部 いちぶ 細胞 さいぼう 表面 ひょうめん 結合 けつごう 細胞 さいぼう 内 ない 侵入 しんにゅう 毒性 どくせい 示 しめ 細胞 さいぼう 侵入 しんにゅう 際 さい 結合 けつごう 部分 ぶぶん 抗体 こうたい 結合 けつごう 微生物 びせいぶつ 毒素 どくそ 細胞 さいぼう 結合 けつごう 毒性 どくせい 示 しめ 抗体 こうたい 結合 けつごう 微生物 びせいぶつ 感染 かんせん 力 りょく 低下 ていか 毒素 どくそ 毒性 どくせい 減少 げんしょう 例 たと インフルエンザウイルス は、ウイルス表面 ひょうめん 気道 きどう 上皮 じょうひ 細胞 さいぼう 酸 さん 残 ざん 基 もと 結合 けつごう 細胞 さいぼう 内 ない 侵入 しんにゅう 対 たい 抗体 こうたい 感染 かんせん 力 りょく 低下 ていか 中和 ちゅうわ 作用 さよう
免疫 めんえき 多様 たよう 性 せい [ 編集 へんしゅう ] あらゆる抗原 こうげん 対応 たいおう 体内 たいない 可変 かへん 領域 りょういき 異 こと 重 じゅう 鎖 くさり 軽 けい 鎖 くさり 何 なん 百 ひゃく 何 なん 千 せん 万 まん 種類 しゅるい 用意 ようい 抗体 こうたい 多様 たよう 性 せい 作 つく 出 だ 長 なが 間 あいだ 不明 ふめい 1897年 ねん エールリヒ は、もともとさまざまな抗原 こうげん 対 たい 鋳型 いがた 細胞 さいぼう 表面 ひょうめん 細胞 さいぼう 鋳型 いがた 抗原 こうげん 出会 であ 刺激 しげき 抗原 こうげん 対 たい 抗体 こうたい 産 さん 生 せい 考 かんが 側 がわ 鎖 くさり 説 せつ [9] ラントシュタイナー は、新 あたら 人工 じんこう 合成 ごうせい 化合 かごう 物 ぶつ 対 たい 抗体 こうたい 作用 さよう 示 しめ 世 よ 物質 ぶっしつ 対 たい 鋳型 いがた 細胞 さいぼう 持 も 考 かんが 抗体 こうたい 多様 たよう 性 せい 側 がわ 鎖 くさり 説 せつ 説明 せつめい 考 かんが 後 ご 抗体 こうたい 抗原 こうげん 出会 であ 結合 けつごう 自 みずか 姿 すがた 変 か 説 せつ 鋳型 いがた 説 せつ 抗原 こうげん 刺激 しげき 抗体 こうたい 後天的 こうてんてき 作 つく 説 せつ 指令 しれい 説 せつ 唱 とな 1959年 ねん エーデルマン が免疫 めんえき 基本 きほん 構造 こうぞう 解明 かいめい [10] [11] 1958年 ねん クリック により、タンパクは遺伝子 いでんし 情報 じょうほう 基 もと 作 つく 明 あき セントラルドグマ )と、鋳型 いがた 説 せつ 指令 しれい 説 せつ 否定 ひてい 的 てき 考 かんが 代 か バーネット の提唱 ていしょう クローン選択 せんたく 説 せつ [12] 1957年 ねん )が受 う 入 い 球 だま 種類 しゅるい 抗体 こうたい 作 つく 体内 たいない 非常 ひじょう 多 おお 種類 しゅるい 球 だま 先天的 せんてんてき 用意 ようい 抗原 こうげん 体内 たいない 侵入 しんにゅう 抗原 こうげん 結合 けつごう 球 だま 選 えら 増殖 ぞうしょく 抗原 こうげん 対 たい 抗体 こうたい 産 さん 生 せい 説 せつ 説 せつ 種々 しゅじゅ 実験 じっけん 正当 せいとう 性 せい 証明 しょうめい 選択 せんたく 説 せつ 側 がわ 鎖 くさり 説 せつ 同 おな 全 まった 未知 みち 抗原 こうげん 対応 たいおう 抗体 こうたい 遺伝子 いでんし 用意 ようい 点 てん 不明 ふめい 非常 ひじょう 多 おお 種類 しゅるい 抗体 こうたい 構造 こうぞう 全 すべ 遺伝子 いでんし 書 か 込 こ 考 かんが
1976年 ねん 利根川 とねがわ 免疫 めんえき 遺伝子 いでんし 再 さい 構成 こうせい 現象 げんしょう 発見 はっけん [13] [14] 抗体 こうたい 多様 たよう 性 せい 関 かん 遺伝子 いでんし 謎 なぞ 答 こた 出 だ 他 た 体 からだ 細胞 さいぼう 超 ちょう 変異 へんい 遺伝子 いでんし 変換 へんかん 組 く 換 か 現象 げんしょう 抗体 こうたい 多様 たよう 性 せい 関与 かんよ 知 し [15]
V(D)J遺伝子 いでんし 再 さい 構成 こうせい [ 編集 へんしゅう ] B細胞 さいぼう 分化 ぶんか 前 まえ 生殖 せいしょく 細胞 さいぼう 遺伝子 いでんし 重 じゅう 鎖 くさり 可変 かへん 領域 りょういき H ) をコードする遺伝子 いでんし H 遺伝子 いでんし 部分 ぶぶん H 遺伝子 いでんし 部分 ぶぶん H 遺伝子 いでんし 部分 ぶぶん 分 わ 遺伝子 いでんし 部分 ぶぶん 可変 かへん 領域 りょういき 遺伝子 いでんし 断片 だんぺん 複数個 ふくすうこ 抗体 こうたい 産 さん 生 せい 細胞 さいぼう 重 じゅう 鎖 くさり 可変 かへん 領域 りょういき 遺伝子 いでんし H 遺伝子 いでんし 部分 ぶぶん 遺伝子 いでんし 断片 だんぺん 中 なか 種類 しゅるい H 遺伝子 いでんし 部分 ぶぶん 種類 しゅるい H 遺伝子 いでんし 部分 ぶぶん 種類 しゅるい 選 えら 組 く 立 た H 遺伝子 いでんし 部分 ぶぶん 遺伝子 いでんし 断片 だんぺん H 遺伝子 いでんし 部分 ぶぶん 遺伝子 いでんし 断片 だんぺん H 遺伝子 いでんし 部分 ぶぶん 種類 しゅるい 遺伝子 いでんし 断片 だんぺん 組 く 合 あ 種類 しゅるい
軽 けい 鎖 くさり 可変 かへん 領域 りょういき L ) をコードする遺伝子 いでんし 重 じゅう 鎖 くさり 少 すく L 遺伝子 いでんし 部分 ぶぶん L 遺伝子 いでんし 部分 ぶぶん 部分 ぶぶん 同 おな L 遺伝子 いでんし 部分 ぶぶん 遺伝子 いでんし 断片 だんぺん L 遺伝子 いでんし 部分 ぶぶん 遺伝子 いでんし 断片 だんぺん 組 く 合 あ 種類 しゅるい 種類 しゅるい 重 じゅう 鎖 くさり 種類 しゅるい 軽 けい 鎖 くさり 組 く 合 あ 万 まん 種類 しゅるい 以上 いじょう 重 じゅう 鎖 くさり 軽 けい 鎖 くさり 遺伝子 いでんし 断片 だんぺん 組 く 合 あ 多様 たよう 遺伝子 いでんし 細胞 さいぼう 異 こと 種類 しゅるい 細胞 さいぼう 異 こと 抗体 こうたい 作 つく 多様 たよう 抗体 こうたい [13] [16] 遺伝子 いでんし 再 さい 構成 こうせい 主 おも
各 かく 細胞 さいぼう 遺伝子 いでんし 再 さい 構成 こうせい 起 お 相 あい 同 どう 染色 せんしょく 体 たい 片方 かたがた 再 さい 構成 こうせい 遺伝子 いでんし 不 ふ 活 かつ 化 か
体 からだ 細胞 さいぼう 超 ちょう 変異 へんい [ 編集 へんしゅう ] 幹 みき 細胞 さいぼう 分化 ぶんか 体 からだ 細胞 さいぼう 分化 ぶんか 分化 ぶんか 細胞 さいぼう 体 からだ 細胞 さいぼう 幹 みき 細胞 さいぼう 体 からだ 細胞 さいぼう 分化 ぶんか 稀 まれ 遺伝子 いでんし 変異 へんい 起 お 体 からだ 細胞 さいぼう 変異 へんい 細胞 さいぼう 変異 へんい 頻度 ひんど 極 きわ 高 たか 万 まん 倍 ばい 及 およ [17] 末梢 まっしょう 成熟 せいじゅく 細胞 さいぼう 中 なか 細胞 さいぼう 依存 いぞん 性 せい 抗原 こうげん 活性 かっせい 細胞 さいぼう 胚 はい 中心 ちゅうしん 形成 けいせい 微小 びしょう 環境 かんきょう 内 ない 免疫 めんえき 遺伝子 いでんし 領域 りょういき AID (activation-induced cytidine deaminase)により様々 さまざま 塩基 えんき 置換 ちかん 引 ひ 起 お 体 からだ 細胞 さいぼう 超 ちょう 変異 へんい 抗体 こうたい 多様 たよう 性 せい 親和 しんわ 性 せい 成熟 せいじゅく 関与 かんよ [15]
遺伝子 いでんし 変換 へんかん [ 編集 へんしゅう ] V(D)J遺伝子 いでんし 再 さい 構成 こうせい 終 お 可変 かへん 領域 りょういき 遺伝子 いでんし 遺伝子 いでんし 上流 じょうりゅう 存在 そんざい 偽 にせ 遺伝子 いでんし 置換 ちかん 多様 たよう 性 せい 遺伝子 いでんし 変換 へんかん 主 おも [18] [19] 1986年 ねん レイノーらにより報告 ほうこく [20] [21]
クラススイッチ組 く 換 か [ 編集 へんしゅう ] V(D)J遺伝子 いでんし 再 さい 構成 こうせい 等 とう 過程 かてい 経 へ 生 う 細胞 さいぼう 抗原 こうげん 刺激 しげき 受 う 成熟 せいじゅく 化 か 増殖 ぞうしょく 際 さい 重 じゅう 鎖 くさり 定常 ていじょう 領域 りょういき H ) をコードする遺伝子 いでんし 改変 かいへん 起 お 最初 さいしょ 分泌 ぶんぴつ 細胞 さいぼう 等 とう 他 た 免疫 めんえき 産 さん 生 せい 同 おな 可変 かへん 領域 りょういき 異 こと 定常 ていじょう 領域 りょういき 組 く 合 あ 多様 たよう 抗体 こうたい 作 つく 出 だ 組 く 換 か [15]
近年 きんねん モノクローナル抗体 こうたい の持 も 特異 とくい 性 せい 利用 りよう 医薬品 いやくひん 開発 かいはつ 進 すす 抗体 こうたい 医薬 いやく 標的 ひょうてき 抗原 こうげん 対 たい 特異 とくい 的 てき 働 はたら 医薬品 いやくひん 副作用 ふくさよう 軽減 けいげん 高 たか 治療 ちりょう 効果 こうか 得 え 期待 きたい 年 ねん 現在 げんざい 関節 かんせつ 治療 ちりょう 薬 やく 抗 こう TNF-α あるふぁ 抗体 こうたい インフリキシマブ や抗 こう IL-6 抗体 こうたい トシリズマブ 、癌 がん 遺伝子 いでんし 対 たい 抗体 こうたい トラスツズマブ などがすでに臨床 りんしょう 使用 しよう
^ 2.抗体 こうたい 産 さん 生 せい 科学 かがく 技術 ぎじゅつ 振興 しんこう 機構 きこう 年 ねん 月 がつ 日 にち 閲覧 えつらん ^ Hamers-Casterman, C. et al., "Naturally occurring antibodies devoid of light chains", Nature 363 , 446−448 (1993). doi :10.1038/363446a0 、W.W.ギブズ, 「開発 かいはつ 進 すす 抗体 こうたい 医薬 いやく 日経 にっけい 年 ねん 月 がつ 号 ごう
^ Porter RR. "The hydrolysis of rabbit γ がんま Biochemical Journal , 73, 1959, p.p. 119-127. PMID 14434282
^ Nisonoff A, Wissler FC, Lipman LN, Woernley DL. "Separation of univalent fragments from the bivalent rabbit antibody molecule by reduction of disulfide bonds." Archives of biochemistry and biophysics , 89, 1960, p.p. 230-44. PMID 14427334
^ https://www.perkinelmer.co.jp/assays/tabid/1875/Default.aspx ^ a b 宮坂 みやさか 昌之 まさゆき 標準 ひょうじゅん 免疫 めんえき 学 がく 医学書院 いがくしょいん 年 ねん 月 がつ 日 にち 第 だい 版 はん 第 だい 刷 さつ
^ Stavnezer J, Amemiya CT. "Evolution of isotype switching" Semin. Immunol. 16, 2006, p.p. 257-275. PMID 15522624
^ a b c d e 河本 かわもと 宏 ひろし 免疫 めんえき 学 がく 年 ねん 月 がつ 日 にち 第 だい 刷 さつ
^ Silverstein AM. "Paul Ehrlich's passion: the origins of his receptor immunology." Cellular Immunology , 194, 1999, p.p. 213-221. PMID 10383824
^ Edelman GM. "Journal of American Chemical Society", 81, 1959, p.p. 3155.
^ Edelman GM, Poulik MD. "Studies on structural units of the gamma-globulins." Journal of Experimental Medicine , 113, 1961, p.p. 861-884. PMID 13725659
^ Burnet FM. "A modification of Jerne's theory of antibody production using the concept of clonal selection." Australian Journal of Science , 20, 1957, p.p. 67-69.
^ a b Hozumi N, Tonegawa S. "Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions." Proceedings of National Academy of Science of United States of America , 73, 1976, p.p. 3628-3632. PMID 824647
^ Tonegawa S. "Somatic generation of antibody diversity." Nature , 302, 1983, p.p. 575-581. PMID 6300689
^ a b c Li Z, Woo CJ, Iglesias-Ussel MD, et al. "The generation of antibody diversity throuth somatic hypermutation and class switch recombination." Gene & Development , 18, 2004, p.p. 1-11. PMID 14724175
^ Market E, Papavasiliou FN. "V(D)J recombination and the evolution of the adaptive immune system." PloS Biology , 1, 2003, p.p. 24-27. PMID 14551913
^ Rajewsky K, Forster I, Cumano A. "Evolutionary and somatic selection of the antibody repertoire in the mouse." Science , 238, 1987, p.p. 1088-1094. PMID 3317826
^ Weill JC, Reynaud CA, Lassila O, Pink JR. "Rearrangement of chicken immunoglobulin genes is not an ongoing process in the embryonic bursa of Fabricius." Proceedings of National Academy of Science of United States of America , 83, 1986, p.p. 3336-3340. PMID 3010290
^ Weill JC, Reynaud CA. "Rearrangement/hypermutation/gene conversion: When, where and why?" Immunology Today , 17, 1996, p.p. 92 -97. PMID 8808057
^ Reynaud CA, Anquez V, Dahan A, Weill JC. "A single rearrengement event generates most of the chicken immunoglobulin light chain diversity." Cell , 40, 1985, p.p. 283-291. PMID 3917859
^ "系統 けいとう 看護 かんご 学 がく 講座 こうざ 専門 せんもん 基礎 きそ 解剖 かいぼう 生理学 せいりがく 人体 じんたい 構造 こうぞう 機能 きのう 医学書院 いがくしょいん
ウィキメディア・コモンズには、
抗体 こうたい に
関連 かんれん するカテゴリがあります。