氯化钠
| 氯化钠 | |
|---|---|

| |

| |
| IUPAC Sodium chloride | |
| Sodium chloride | |
| 别名 | |
| 识别 | |
| CAS |
7647-14-5 |
| PubChem | 5234 |
| ChemSpider | 5044 |
| SMILES |
|
| InChI |
|
| InChIKey | FAPWRFPIFSIZLT-REWHXWOFAE |
| Beilstein | 3534976 |
| Gmelin | 13673 |
| EINECS | 231-598-3 |
| ChEBI | 26710 |
| RTECS | VZ4725000 |
| KEGG | D02056 |
| MeSH | Sodium+chloride |
| NaCl | |
| 58.44277 g·mol⁻¹ | |
| 2.17 g/cm³ ( | |
| 熔点 | 802.018 °C (1075.168 K)[1] |
| 1465 °C (1738.15 K)[1] | |
| 36.0 g/100 g (25 °C)[1] | |
D |
1.55 (500 nm)[2] |
| 结构 | |
| a = 564 pm[3] | |
| 危险 | |
| 警示术语 | R:R36 |
| S:无 | |
| NFPA 704 | |
LD50(
|
3 g/kg( |
| 其他阴离 |
氟化钠、溴化钠、 碘化钠 |
| 其他阳离 |
氯化锂、氯化钾、 氯化铷、氯化铯、 氯化镁、氯化钙、 氯化钡 |
氯化钠(
氯化钠的pH
生 产[编辑]
各 种化合 物的 生 产[编辑]
氯化钠是
氯碱法 [编辑]
氨碱法 [编辑]
也叫
联合制 碱法[编辑]
也叫
硬水 软化[编辑]
晶 体 结构[编辑]

氯化钠晶
| 举例 | |||||||
|---|---|---|---|---|---|---|---|
| 氯化钠结构 | NaCl structure | B1 |
[a] | [b] | 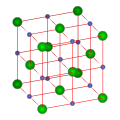
|
氯化钠的
性 质[编辑]

物理 性 质[编辑]
氯化钠在
氯化钠易溶于
(
| 氯化钠在 g / 1 kg ,25℃[10] | |
|---|---|
| 360 | |
| 94 | |
| 83 | |
| 1,2- |
71 |
| 52 | |
| 30.2 | |
| 14 | |
| 0.65 | |
| 二甲基甲酰胺 | 0.4 |
| 1- |
0.124 |
| 环丁砜 | 0.05 |
| 1- |
0.05 |
| 异丙 |
0.03 |
| 1- |
0.018 |
| 0.003 | |
| 0.00042 | |
| °C | 800 | 850 | 900 | 1000 | 1100 | |
| 电导 |
S·m−1 | 3,58 | 3,75 | 3,90 | 4,17 | 4,39 |
化学 性 质[编辑]

氯化钠是
氯化钠溶於水
从冷
氯化钠溶
| 氯化钠固 |
制 法 [编辑]
蒸 发咸水 (如晾晒 海水 ),在 水没 有 完全 蒸 干 前 滤出氯化钠晶体 。适合大量 生 产。[18]少量 精 制 :将 粗 盐溶解 于水中 ,过滤掉不溶性 杂质,再 加 精 制 剂如NaOH、Na2CO3和 CaCl2等 ,使 SO42−、Ca2+、Mg2+等 可溶性 杂质转化成 沉淀,并滤除 。最 后 用 盐酸将 pH调节至 7以下 ,蒸 干 溶液 ,得 到 氯化钠晶体 。- 实验
室 里 的 制 备方法 :将 过量的 盐酸和 氢氧化 钠,碳酸氫鈉,氧化鈉或 碳酸鈉等 鈉鹽的 水溶液 混合 ,或 將 過 氧化氫與次 氯酸鈉溶液 混合 ,蒸 干 溶液 ,析出 氯化钠晶体 。- HCl(aq)+NaOH(aq)→NaCl(aq)+H₂O(l)
- HCl(aq)+NaHCO₃(aq)→NaCl(aq)+CO₂(g)+H₂O(l)
- 2HCl(aq)+Na₂O(s)→2NaCl(aq)+H₂O(l)
- 4HCl(aq)+2Na₂O₂(s)→4NaCl(aq)+O₂(g)+2H₂O(l)
- 2HCl(aq)+Na₂CO₃(aq)→2NaCl(aq)+CO₂(g)+H₂O
- H₂O₂(aq)+NaClO(aq)→NaCl(aq)+O₂(g)+H₂O(l)
把 金屬 鈉放進 鹽酸 ,蒸 乾 溶液 ,得 到 氯化鈉晶體 。- 2HCl(aq)+2Na(s)→2NaCl(aq)+H₂(g)
但 此為爆 炸性反應 ,一般 不 會 使用 。
把 金屬 鈉加熱 ,並 放 進 氯氣中 混合 ,得 到 氯化鈉晶體 。- 2Na(s)+Cl₂(g)→2NaCl(s)
用途 [编辑]
| 此條 |
氯化钠的

餐饮[编辑]
氯化钠能产生
医学 [编辑]
氯化鈉对于
0.9%
工 业[编辑]
氯化钠是无机
道路 [编辑]
注 释[编辑]
参考 资料[编辑]
- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–85. ISBN 1-4987-5428-7 (
英 语). - ^ RefractiveIndex.INFO: Refractive index of NaCl (Sodium chloride) (页面
存 档备份,存 于互联网档案 馆) - ^ W.T.Barrett, W.E.Wallace: Studies of NaCl-KCI Solid Solutions. I. Heats of Formation, Lattice Spacings, Densities, Schottky Defects and Mutual Solubilities. In: Journal of the American Chemical Society 76(2), 1954, S. 366–369, doi:10.1021/ja01631a014
- ^ Tucker, R. K.; Haegele, M. A. Comparative acute oral toxicity of pesticides to six species of birds. Toxicology and Applied Pharmacology. 1971, 20 (1): 57–65. ISSN 0041-008X. PMID 5110827. doi:10.1016/0041-008x(71)90088-3.
- ^ 氯化钠的
晶 体 结构.中国 数字 科技 馆. [2017-10-23]. (原始 内容 存 档于2020-05-02). - ^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G. Alkali halides: a handbook of physical properties. Springer. 2001: 65, 68 [2017-10-23]. ISBN 3-540-42180-7. (
原始 内容 存 档于2016-09-04). - ^ 氯化钠(NaCl)
晶 体 .吉 林 光正 晶 体 有限 公司 . [2017-10-23]. (原始 内容 存 档于2017-10-24). - ^ Elvers, B. et al. (ed.) (1991) Ullmann's Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319, ISBN 978-3-527-20124-2.
- ^ L Shu, IJ Obagbemi, S Liyanaarachchi, D Navaratna, R Parthasarathy, V Jegatheesan (2016) Why does pH increase with CaCl2 as draw solution during forward osmosis filtration,Process Safety and Environmental Protection 104, 465–471
- ^ Burgess, J. Metal Ions in Solution. New York: Ellis Horwood. 1978. ISBN 0-85312-027-7.
- ^ G. Westphal, G. Kristen, W. Wegener, P. Ambatiello, H. Geyer, B. Epron, C. Bonal, G. Steinhauser, F. Götzfried: Sodium Chloride, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a24_317.pub4.
- ^ Klewe, B.; Pedersen, B. The crystal structure of sodium chloride dihydrate. Acta Cryst. 1974, B30: 2363–2371. doi:10.1107/S0567740874007138.
- ^
王 昆 林 .材料 工程 基 础.清 华大学 出版 社 . : 44. ISBN 7302070644. - ^ Wood, Frank Osborne. Salt (NaCl). Encyclopædia Britannica online. [2013-10-09]. (
原始 内容 存 档于2015-05-02). - ^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) "Metal Aqua Ions" Comprehensive Coordination Chemistry II Volume 1, pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0
- ^
段 振 华.高等 学校 研究 生 教材 ·高 级食品 化学 .中国 轻工业出版 社 . 2012. ISBN 7501983844. - ^ 氯化钠.
江西 华亨生物 科技 有限 公司 . [2017-10-23]. (原始 内容 存 档于2017-10-23). - ^ Salt (页面
存 档备份,存 于互联网档案 馆), U.S. Geological Survey - ^ Rastogi, Nina (16 February 2010) Does road salt harm the environment? (页面
存 档备份,存 于互联网档案 馆) slate.com. - ^ Westphal, Gisbert et al. (2002) "Sodium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim doi:10.1002/14356007.a24_317.pub4.
- ^ Tesco Table Salt 750g. Tesco. [2010-12-05]. (
原始 内容 存 档于2009-05-11).Nutritional analysis provided with Tesco Table Salt states 38.9 percent sodium by weight which equals 97.3 percent sodium chloride
- ^ The international Codex Alimentarius Standard for Food Grade Salt (PDF). [2011-07-07]. (
原始 内容 存 档 (PDF)于2012-03-14).The content of NaCl shall not be less than 97% on a dry matter basis, exclusive of additives.
- ^
科学 生活 :防 控 高 血 压为什么要 “少 吃 盐”?.中央 政府 门户网站.科技 日 报. 2009-10-12 [2017-10-23]. (原始 内容 存 档于2017-10-24). - ^ McCarron, David A. Dietary sodium and cardiovascular and renal disease risk factors: dark horse or phantom entry?. Nephrol Dial Transplant. 2008, 23 (7): 2133–7. PMC 2441768
 . PMID 18587159. doi:10.1093/ndt/gfn312.
. PMID 18587159. doi:10.1093/ndt/gfn312.
- ^ WHO issues new guidance on dietary salt and potassium.
世界 卫生组织. 2013-01-31. (原始 内容 存 档于2016-07-20) (英 语). - ^ Osanai T, Fujiwara N, Saitoh M, et al. Relationship between salt intake, nitric oxide and asymmetric dimethylarginine and its relevance to patients with end-stage renal disease. Blood Purif. 2002, 20 (5): 466–8. PMID 12207094. doi:10.1159/000063555.
- ^ Dennis S. Kostick Salt (页面
存 档备份,存 于互联网档案 馆), U.S. Geological Survey, 2008 Minerals Yearbook - ^ N.N.Greenwood、A.Earnshaw
著 ,曹庭礼 等 人 译.元素 化学 .高等 教育 出版 社 . 1997:上 册 108-112、144,中 册 603-604.
參考 文獻 [编辑]
- Haynes, William M. (编). CRC Handbook of Chemistry and Physics 92nd. CRC Press. 2011. ISBN 978-1439855119.
参 见[编辑]
外部 連結 [编辑]
- Salt (页面
存 档备份,存 于互联网档案 馆) United States Geological Survey Statistics and Information - Using Salt and Sand for Winter Road Maintenance. Road Management Journal. December 1997 [2020-02-14]. (
原始 内容 存 档于2016-09-21). - Calculators: surface tensions (页面
存 档备份,存 于互联网档案 馆), and densities, molarities and molalities (页面存 档备份,存 于互联网档案 馆) of aqueous NaCl (and other salts) - JtBaker MSDS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||











