藍 藻
| シアノバクテリア | ||||||
|---|---|---|---|---|---|---|
  1. (
| ||||||
| ||||||
| Cyanobacteria Stanier ex Cavalier-Smith, 2002 | ||||||
| シアノバクテリア[2]、 | ||||||
| cyanobacteria[5], cyanoprokaryotes[6], blue-green algae[5], cyanophytes[5] | ||||||
|
体制 [編集 ]

単細胞 性 (unicellular)体 が1個 の細胞 からなる (下図 3)。細胞 の形 は球状 や桿状のものが多 く(例 : Synechococcus, Synechocystis)、また異 極性 (heteropolarity;基 端 と先端 で形態 が異 なる)を示 す種 もいる(例 : Chamaesiphon;下図 16a)[14]。
群 体 性 (colonial)体 が複数 の細胞 からなるが、細胞 が密接 していない、細胞 の分化 が見 られないなど多 細胞 とは呼 び難 いもの(多分 に伝統 的 な区分 であり、明確 な定義 は難 しい)(下図 4)。群 体 全体 の形態 は多様 である(不定 形 、球形 、多面体 、シート状 、ひも状 など)[14]。また群 体様 式 としては、多数 の細胞 が共通 の粘液質 に包 まれたパルメラ状 群 体 (palmelloid colony;例 :Aphanocapsa)が多 いが、他 にも細胞 が密着 して塊状 になるサルシナ状 群 体 (sarcinoid colony;例 :Cyanosarcina)や、分岐 する粘液質 の柄 の先端 にそれぞれ細胞 が位置 する樹 状 群 体 (dendroid colony)などがある[14]。
糸状 性 (filamentous)

細胞 [編集 ]
細胞 外 被 [編集 ]
さらに
細胞 内 構造 [編集 ]
ふつう
プランクトン
光合成 [編集 ]
ほとんどの
ほとんどの
窒素 固定 [編集 ]

ゲノム[編集 ]

運動 [編集 ]
また
生殖 [編集 ]
ネンジュモ
生態 [編集 ]
共生 [編集 ]

人間 との関 わり[編集 ]
害 [編集 ]
アクアリウムにおいては、
食用 [編集 ]
アフリカや
その他 [編集 ]
進化 [編集 ]
ゲノムレベルでの

いずれにせよ、
分類 [編集 ]
クロロフィル b をもつ
| バージェイ |
|||
|---|---|---|---|
| クロオコックス |
subsection I | Synechococcus, Synechocystis, Chroococcus, Aphanocapsa, Coelosphaerium, Merismopedia, Microcystis | |
| プレウロカプサ |
subsection II | Pleurocapsa, Chroococcidiopsis, Xenococcus | |
| ユレモ |
subsection III | Oscillatoria, Phormidium, Lyngbya, Arthrospira, Planktothrix, Pseudanabaena | |
| ネンジュモ |
subsection IV | Anabaena, Nostoc, Aphanizomenon, Cylindrospermum, Calothrix, Scytonema | |
| スチゴネマ |
subsection V | Stigonema, Hapalosiphon, Fischerella |
しかし
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 27. |
2019
|
ギャラリー[編集 ]
-
滑走 運動 する糸状 性 藍 藻 -
スピルリナ (Arthrospira platensis)
-
スロンボライト
-
藍 藻 を捕食 した Frontonia(繊毛 虫 )
脚注 [編集 ]
注釈 [編集 ]
- ^ a b c d
光合成 能 をもたない。シアノバクテリア門 には含 めないこともある[7]。 - ^ a b この
名 はまだ一般 的 ではなく、植物 命名 規約 に基 づく「藍 藻 綱 (Cyanophyceae)」が暫定 的 に用 いられることがある[8]。 - ^
目 レベルの分類 は過渡 的 であり、必 ずしも系統 を反映 していない (本文 参照 )。 - ^ 2019
年 現在 、高等 学校 の教育 指導 要領 や、(「高等 学校 の生物 教育 における重要 用語 の選定 について (改訂 )」『学術 の動向 』第 24巻 第 8号 、日本 学術 協力 財団 、2019年 、8_86-8_87、doi:10.5363/tits.24.8_86、ISSN 1342-3363、NAID 130007769442。)では、「シアノバクテリア」が選定 されている。 - ^
酸素 非 発生 型 とも表記 される[11]。 - ^
補色 適応 (chromatic adaptation) ともよばれる[5][80]。 - ^ ヘテロシスト (heterocyst) ともよばれるが、
一般 的 な意味 でのシスト (休眠 細胞 ) ではない[93]。 - ^ これらの
藍 藻 はいくつかの属 に分 けることが提唱 されている[116]。ただし2019年 現在 、これらの新 しい属 名 は一般 的 ではない。 - ^ アナベナ
属 (Anabaena) とされていた藍 藻 のうち、プランクトンとしてふつうに見 られる種 の多 くは、ドリコスペルマム属 に移 されている[122] - ^ ただし2019
年 現在 、原核 生物 の分類 体系 では、藍 藻 を分類 する一般 的 な綱 レベルの分類 群 名 がないため、藍 藻 綱 (Cyanophyceae) が暫定 的 に用 いられることがある[8]。 - ^
外 生 胞子 (エクソサイト) を形成 するものはカマエシフォン目 (Chamaesiphonales) として分 けられることもあった[12]。 - ^
一般 的 に「スピルリナ」とよばれる藍 藻 は Arthrospira に属 する[193] (この分類 体系 ではユレモ目 )。
出典 [編集 ]
- ^ a b c
山本 純 之 ,磯 﨑行雄 「ストロマトライト研究 の歴史 と今後 の展望 」『地學 雜誌 』第 122巻 第 5号 、東京 地学 協会 、2013年 、791-806頁 、doi:10.5026/jgeography.122.791、ISSN 0022-135X、NAID 130003385928。 - ^ a b c
巌 佐 庸 ,倉谷 滋 ,斎藤 成 也 &塚谷 裕一 (編 ) (2013). “藍色 細菌 ”.岩波 生物 学 辞典 第 5版 .岩波書店 . pp. 1445–1446. ISBN 978-4000803144 - ^ a b c d e f
渡辺 信 (1999). “藍色 植物 門 ”. In千原 光雄 . バイオディバーシティ・シリーズ (3)藻類 の多様 性 と系統 .裳 華 房 . pp. 160–165. ISBN 978-4785358266 - ^ "ラン
藻 ". ブリタニカ国際 大 百科 事典 小 項目 事典 . コトバンクより2021年 9月 25日 閲覧 。 - ^ a b c d e f Graham, J.E., Wilcox, L.W. & Graham, L.E. (2008). “Cyanobacteria”. Algae. Benjamin Cummings. pp. 94–121. ISBN 978-0321559654
- ^ a b Büdel, B., & Kauff, F. (2012). “Prokaryotic Algae, Bluegreen Algae”. In Frey, W. (eds.). Syllabus of Plant Families. A. Engler's Syllabus der Pflanzenfamilien Part 1/1. Borntraeger. pp. 5-40. ISBN 978-3-443-01061-4
- ^ a b Garcia‐Pichel, F., Zehr, J. P., Bhattacharya, D. & Pakrasi, H. B. (2019). “What's in a name? The case of cyanobacteria”. Journal of Phycology. doi:10.1111/jpy.12934.
- ^ a b “Cyanophyceae”. Algaebase. 2021
年 9月 23日 閲覧 。 - ^ a b c d e
井上 勲 (2006).藻類 30億 年 の自然 史 -藻類 からみる生物 進化 -.東海大学 出版 会 . ISBN 4486017773. NCID BA75032272 - ^ “
非 酸素 発生 型 光合成 ”.光合成 事典 (Web版 ).日本 光合成 学会 (2020年 5月 12日 ). 2022年 11月11日 閲覧 。 - ^
嶋田 敬三 「光合成 細菌 」『低温 科学 』第 67巻 、2009年 、3-7頁 。 - ^ a b c
千原 光雄 (1997). “藍色 植物 門 ”.藻類 多様 性 の生物 学 .内田 老 鶴 圃. pp. 27–39. ISBN 978-4753640607 - ^ a b van den Hoek, C., Mann, D., Jahns, H. M. & Jahns, M. (1995). Algae: an introduction to phycology. Cambridge University Press. ISBN 978-0521316873
- ^ a b c d e f g h i Komárek, J. (2003). “Coccoid and colonial cyanobacteria”. In Wehr, J.D. & Sheath, R.G.. Freshwater Algae of North America. Ecology and Classification. Boston, MA: Academic Press. pp. 59-116. ISBN 978-0127415505
- ^ a b c d Komárek, J., Kling, H. & Komárková, J. (2003). “Filamentous cyanobacteria”. In Wehr, J.D. & Sheath, R.G.. Freshwater Algae of North America. Ecology and Classification. Boston, MA: Academic Press. pp. 117-196. ISBN 978-0127415505
- ^ Mahasneh, I.A., Grainger, S.L.J. & Whitton, B.A. (1990). “Influence of salinity on hair formation and phosphatase-activities of the blue-green-alga (cyanobacterium) Calothrix viguieri D253”. Br. Phycol. J. 25: 25-32. doi:10.1080/00071619000650021.
- ^ a b c d Flores, E. & Herrero, A. (2010). “Compartmentalized function through cell differentiation in filamentous cyanobacteria”. Nature Reviews Microbiology 8: 39-50. doi:10.1038/nrmicro2242.
- ^ Singh, S.P. & Montgomery, B.L. (2011). “Determining cell shape: adaptive regulation of cyanobacterial cellular differentiation and morphology”. Trends in Microbiology 19: 278-285. doi:10.1016/j.tim.2011.03.001.
- ^ a b c Hoiczyk, E. & Hansel, A. (2000). “Cyanobacterial cell walls: News from an unusual prokaryotic envelope”. J. Bacteriol. 182: 1191-1199. doi:10.1128/JB.182.5.1191-1199.2000.
- ^ Stewart, I., Schluter, P.J. & Shaw, G.R. (2006). “Cyanobacterial lipopolysaccharides and human health - a review”. Environ Health 5: 7. doi:10.1186/1476-069X-5-7.
- ^ Flores, E., Herrero, A., Forchhammer, K. & Maldener, I. (2016). “Septal junctions in filamentous heterocyst-forming Cyanobacteria”. Trends in Microbiology 24: 79-82. doi:10.1016/j.tim.2015.11.011.
- ^ Bornikoel, J., Carrión, A., Fan, Q., Flores, E., Forchhammer, K., Mariscal, V., ... & Maldener, I. (2017). “Role of two cell wall amidases in septal junction and nanopore formation in the multicellular cyanobacterium Anabaena sp. PCC 7120”. Frontiers in Cellular and Infection Microbiology 7: 386. doi:10.3389/fcimb.2017.00386.
- ^ Mullineaux, C. W., Mariscal, V., Nenninger, A., Khanum, H., Herrero, A., Flores, E. & Adams, D. (2008). “Mechanism of intercellular molecular exchange in heterocyst-forming cyanobacteria”. EMBO J. 27: 1299-1308. doi:10.1038/emboj.2008.66.
- ^ Šmarda, J., Šmajs, D., Komrska, J. & Krzyžánek, V. (2002). “S-layers on cell walls of cyanobacteria”. Micron 33: 257-277. doi:10.1016/S0968-4328(01)00031-2.
- ^ Ehlers, K. & Oster, G. (2012). “On the mysterious propulsion of Synechococcus”. PLoS One 7: e36081. doi:10.1371/journal.pone.0036081.
- ^ Strom, S. L., Brahamsha, B., Fredrickson, K. A., Apple, J. K. & Rodríguez, A. G. (2012). “A giant cell surface protein in Synechococcus WH8102 inhibits feeding by a dinoflagellate predator”. Environmental Microbiology 14: 807-816. doi:10.1111/j.1462-2920.2011.02640.x.
- ^ Pereira, S., Zille, A., Micheletti, E., Moradas-Ferreira, P., De Philippis, R. & Tamagnini, P. (2009). “Complexity of cyanobacterial exopolysaccharides: composition, structures, inducing factors and putative genes involved in their biosynthesis and assembly”. FEMS Microbiology Reviews 33: 917-941. doi:10.1111/j.1574-6976.2009.00183.x.
- ^ a b Plude, J.L., Parker, D.L., Schommer, O.J., Timmerman, R.J., Hagstrom, S.A., Joers, J.M. & Hnasko, R. (1991). “Chemical characterization of polysaccharide from the slime layer of the cyanobacterium Microcystis flos-aquae C3-40”. Appl. Environ. Microbiol. 57: 1696-1700.
- ^ a b De Philippis, R. & Vincenzini, M. (1998). “Exocellular polysaccharides from cyanobacteria and their possible applications”. FEMS Microbiology Reviews 22: 151-175. doi:10.1111/j.1574-6976.1998.tb00365.x.
- ^ De Philippis, R. & Vincenzini, M. (2003). “Outermost polysaccharidic investments of cyanobacteria: nature, significance and possible applications”. Recent Res. Dev. Microbiol. 7: 13-22.
- ^ a b McCarren, J. & Brahamsha, B. (2009). “Swimming motility mutants of marine Synechococcus affected in production and localization of the S-layer protein SwmA”. J. Bacteriol. 191: 1111-1114. doi:10.1128/JB.01401-08.
- ^ Reynolds, C. S. (2007). “Variability in the provision and function of mucilage in phytoplankton: facultative responses to the environment”. Hydrobiologia 578: 37-45. doi:10.1007/s10750-006-0431-6.
- ^ Sinha, R. P. & Häder D.-P. (2008). “UV-protectants in cyanobacteria”. Plant Science 174: 278-289. doi:10.1016/j.plantsci.2007.12.004.
- ^ Ehling-Schulz, M., Bilger, W. & Scherer, S. (1997). “UV-B-induced synthesis of photoprotective pigments and extracellular polysaccharides in the terrestrial cyanobacterium Nostoc commune”. J. Bacteriol. 179: 1940-1945. doi:10.1128/jb.179.6.1940-1945.1997.
- ^ Storme, J. Y., Golubic, S., Wilmotte, A., Kleinteich, J., Velázquez, D. & Javaux, E. J. (2015). “Raman characterization of the UV-protective pigment gloeocapsin and its role in the survival of cyanobacteria”. Astrobiology 15: 843-857. doi:10.1089/ast.2015.1292.
- ^ Böhm, G. A., Pfleiderer, W., Böger, P. & Scherer, S. (1995). “Structure of a novel oligosaccharide-mycosporine-amino acid ultraviolet A/B sunscreen pigment from the terrestrial cyanobacterium Nostoc commune”. J. Biol. Chem. 270: 8536-8539. doi:10.1074/jbc.270.15.8536.
- ^ Jansson, C. & Northen, T. (2010). “Calcifying cyanobacteria-the potential of biomineralization for carbon capture and storage”. Current Opinion in Biotechnology 21: 365-371. doi:10.1016/j.copbio.2010.03.017.
- ^ a b Reid, R. P., Visscher, P. T., Decho, A. W., Stolz, J. F., Bebout, B. M., Dupraz, C., Macintyre, I. G., Paerl, H. W., Pinckney, J. L., Prufert-Bebout, L., Steppe, T. F. & DesMarais, D. J. (2000). “The role of microbes in accretion, lamination and early lithification of modern marine stromatolites”. Nature 406: 989-992. doi:10.1038/35023158.
- ^ Komárek, J. & Čáslavská, J. (1991). “Thylakoidal patterns in oscillatorialean genera”. Archiv für Hydrobiologie/Algological Studies 64: 267-270.
- ^ a b Mareš, J., Strunecky, O., Bucinska, L. & Wiedermannova, J. (2019) Evolutionary patterns of thylakoid architecture in cyanobacteria. Frontiers in Microbiology 10: 277. https://doi.org/10.3389/fmicb.2019.00277
- ^ Nagarajan, A. & Pakrasi, H. B. (2001). “Membrane‐bound protein complexes for photosynthesis and respiration in cyanobacteria”. eLS: 1–8. doi:10.1002/9780470015902.a0001670.pub2.
- ^ Rippka, R. (1974). “A cyanobacterium which lacks thylakoids”. Archiv für Mikrobiologie 100: 419-436. doi:10.1007/BF00446333.
- ^ a b Cox, G. (1993). “Prochlorophyceae”. In Berner, T.. Ultrastructure of Microalgae. CRC Press. pp. 53-70. ISBN 9780849363238
- ^ Hahn, A. & Schleiff, E. (2014). “The Cell Envelope”. In Flores, E.. Cell Biology of Cyanobacteria. Caister Academic Press. pp. 29-88. ISBN 978-1-908230-92-8
- ^ Nickelsen, J. & Zerges, W. (2013). “Thylakoid biogenesis has joined the new era of bacterial cell biology”. Frontiers in Plant Science 4: 458. doi:10.3389/fpls.2013.00458.
- ^ Rast, A., Heinz, S. & Nickelsen, J. (2015). “Biogenesis of thylakoid membranes”. Biochimica et Biophysica Acta (BBA)-Bioenergetic 1847: 821-830. doi:10.1016/j.bbabio.2015.01.007.
- ^ a b Geitler, L. (1932). “Cyanophyceae”. In Rabenhorst, L.. Kryptogamen-Flora. 14. Band. Akademische Verlagsgesellschaft. pp. 1196
- ^ a b c d Price, G. D., Badger, M. R., Woodger, F. J. & Long, B. M. (2008). “Advances in understanding the cyanobacterial CO2-concentrating-mechanism (CCM): functional components, Ci transporters, diversity, genetic regulation and prospects for engineering into plants”. Journal of Experimental Botany 59: 1441-1461. doi:10.1093/jxb/erm112.
- ^ Yeates, T. O., Kerfeld, C. A., Heinhorst, S., Cannon, G. C. & Shively, J. M. (2008). “Protein-based organelles in bacteria: carboxysomes and related microcompartments”. Nature Reviews Microbiology 6: 681-691. doi:10.1038/nrmicro1913.
- ^ Colman, B. (1989). “Photosynthetic carbon assimilation and the suppression of photorespiration in the cyanobacteria”. Aquat. Bot. 34: 211-231. doi:10.1016/0304-3770(89)90057-0.
- ^ Bauwe, H., Hagemann, M. & Fernie, A. R. (2010). “Photorespiration: players, partners and origin”. Trends in Plant Science 15: 330-336. doi:10.1016/j.tplants.2010.03.006.
- ^ Codd, G.A. & Marsden, W.J.N. (1984). “The carboxysomes (polyhedral bodies) of autotrophic prokarygtes”. Biological Reviews 59: 389-422. doi:10.1111/j.1469-185X.1984.tb00710.x.
- ^ Deschamps, P., Colleoni, C., Nakamura, Y., Suzuki, E., Putaux, J. L., Buléon, A., ... & Moreira, D. (2008). “Metabolic symbiosis and the birth of the plant kingdom”. Molecular Biology and Evolution 25: 536-548. doi:10.1093/molbev/msm280.
- ^ Nakamura, Y., Takahashi, J. I., Sakurai, A., Inaba, Y., Suzuki, E., Nihei, S., ... & Kawachi, M. (2005). “Some cyanobacteria synthesize semi-amylopectin type
α -polyglucans instead of glycogen”. Plant Cell Physiol. 46: 539-545. doi:10.1093/pcp/pci045. - ^ Berg, H., Ziegler, K., Piotukh, K., Baier, K., Lockau, W. & Volkmer‐Engert, R. (2000). “Biosynthesis of the cyanobacterial reserve polymer multi‐L‐arginyl‐poly‐L‐aspartic acid (cyanophycin)”. The FEBS Journal 267: 5561-5570. doi:10.1046/j.1432-1327.2000.01622.x.
- ^ Allen, M. M. (1984). “Cyanobacterial cell inclusions”. Annual Reviews in Microbiology 38: 1-25.
- ^ a b Jensen, T. E. (1993). “Cyanobacterial ultrastructure”. In Berner, T.. Ultrastructure of Microalgae. CRC Press. pp. 7-51
- ^ Moreira, D., Tavera, R., Benzerara, K., Skouri-Panet, F., Couradeau, E., Gérard, E., Fonta, C.L., Novelo, E., Zivanovic, Y. & López-García, P. (2017). “Description of Gloeomargarita lithophora gen. nov., sp. nov., a thylakoid-bearing, basal-branching cyanobacterium with intracellular carbonates, and proposal for Gloeomargaritales ord. nov.”. International Journal of Systematic and Evolutionary Microbiology 67: 653-658. doi:10.1099/ijsem.0.001679.
- ^ Oliver, R.L. (1994). “Floating and sinking in gas-vacuolate cyanobacteria”. Journal of Phycology 30: 161-173. doi:10.1111/j.0022-3646.1994.00161.x.
- ^ Villareal, T. A. & Carpenter, E. J. (2003). “Buoyancy regulation and the potential for vertical migration in the oceanic cyanobacterium Trichodesmium”. Microb. Ecol. 45: 1-10. doi:10.1007/s00248-002-1012-5.
- ^ Walsby, A.E. (1987). “Mechanisms of buoyancy regulation by planktonic cyanobacteria with gas vesicles”. In P. Fay & C. Van Baalen. The Cyanobacteria. Elsevier. pp. 377-414
- ^ Shukla, H. D. & DasSarma, S. (2004). “Complexity of gas vesicle biogenesis in Halobacterium sp. strain NRC-1: identification of five new proteins”. Journal of Bacteriology 186: 3182-3186. doi:10.1128/JB.186.10.3182-3186.2004.
- ^
三室 守 (1999). “光合成 色素 にみられる多様 性 ”. In千原 光雄 . バイオディバーシティ・シリーズ (3)藻類 の多様 性 と系統 .裳 華 房 . pp. 68–94. ISBN 978-4785358266 - ^ Cohen, Y., Padan, E. & Shilo, M. (1975). “Facultative anoxygenic photosynthesis in the cyanobacterium Oscillatoria limnetica”. J. Bacteriol. 123: 855-861. doi:10.1128/jb.123.3.855-861.1975.
- ^ Cohen, Y., Jorgensen, B. B., Revsbech, N. P. & Poplawski, R. (1986). “Adaptation to hydrogen sulfide of oxygenic and anoxygenic photosynthesis among cyanobacteria”. Applied and Environmental Microbiology 51: 398-407. doi:10.1128/aem.51.2.398-407.1986.
- ^ Rippka, R. (1972). “Photoheterotrophy and chemoheterotrophy among unicellular blue-green algae”. Archiv für Mikrobiologie 87: 93-98. doi:10.1007/BF00424781.
- ^ a b Zehr, J. P., Bench, S. R., Carter, B. J., Hewson, I., Niazi, F., Shi, T., ... & Affourtit, J. P. (2008). “Globally distributed uncultivated oceanic N2-fixing cyanobacteria lack oxygenic photosystem II”. Science 322: 1110-1112. doi:10.1126/science.1165340.
- ^ Tripp, H.J., Bench, S.R., Turk, K.A., Foster, R.A., Desany, B.A., Niazi, F., Affourtit, J.P. & Zehr, J.P. (2010). “Metabolic streamlining in an open-ocean nitrogen-fixing cyanobacterium”. Nature 464: 90-94. doi:10.1038/nature08786.
- ^ Kristiansen, A. (1964). “Sarcinastrum urosporae, a colourless parasitic blue-green alga”. Phycologia 4: 19-22. doi:10.2216/i0031-8884-4-1-19.1.
- ^ Lewin, R. A. & Withers, N. W. (1975). “Extraordinary pigment composition of a prokaryotic alga”. Nature 256: 735–737. doi:10.1038/256735a0.
- ^ Miyashita, H., Adachi, K., Kurano, N., Ikemoto, H., Chihara, M. & Miyachi, S. (1996). “Chlorophyll d as a major pigment”. Nature 383: 402. doi:10.1038/383402a0.
- ^ Chen, M., Schliep, M., Willows, R. D., Cai, Z. -L., Neilan, B. A. & Scheer, H. (2010). “A red-shifted chlorophyll”. Science 329: 1318-1319. doi:10.1126/science.1191127.
- ^ Chisholm, S. W., Olson, R. J., Zettler, E. R., Goericke, R., Waterbury, J. B. & Welschmeyer, N. A. (1988). “A novel free-living prochlorophyte abundant in the oceanic euphotic zone”. Nature 334: 340-343. doi:10.1038/334340a0.
- ^ Goericke, R. & Repeta, D. (1992). “The pigments of Prochlorococcus marinus: the presence of divinyl chlorophyll a and b in a marine prokaryote”. Limnology and Oceanography 37: 425-433. doi:10.4319/lo.1992.37.2.0425.
- ^ Hu, Q., Miyashita, H., Iwasaki, I., Kurano, N., Miyachi, S., Iwaki, M. & Itoh, S. (1998). “A photosystem I reaction center driven by chlorophyll d in oxygenic photosynthesis”. Proc. Natl. Acad. Sci. U.S.A. 95: 13319-13323. doi:10.1073/pnas.95.22.13319.
- ^ Sidler, W. A. (1994). “Phycobilisome and phycobiliprotein structures.”. In Sidler, W. A., & Bryant, D. A.. The Molecular Biology of Cyanobacteria. Springer, Dordrecht. pp. 139-216. ISBN 0792332229
- ^ Singh, N. K., Sonani, R. R., Rastogi, R. P. & Madamwar, D. (2015). “The phycobilisomes: an early requisite for efficient photosynthesis in cyanobacteria”. EXCLI Journal 14: 268–289. doi:10.17179/excli2014-723.
- ^ Bryant, D. A. (1982). “Phycoerythrocyanin and phycoerythrin: properties and occurrence in cyanobacteria”. Microbiology 128: 835-844. doi:10.1099/00221287-128-4-835.
- ^ a b
広瀬 侑、池内 昌彦 、浴 俊彦 「シアノバクテリアの補色 応答 の多様 性 」『PLANT MORPHOLOGY』第 29巻 第 1号 、日本 植物 形態 学会 、2017年 、41-45頁 、doi:10.5685/plmorphol.29.41、ISSN 0918-9726、NAID 130006647120。 - ^
巌 佐 庸 ,倉谷 滋 ,斎藤 成 也 &塚谷 裕一 (編 ) (2013). “補色 順化 ”.岩波 生物 学 辞典 第 5版 .岩波書店 . p. 1307. ISBN 978-4000803144 - ^ Ikeuchi, M. & Ishizuka, T. (2008). “Cyanobacteriochromes: a new superfamily of tetrapyrrole-binding photoreceptors in cyanobacteria”. Photochemical & Photobiological Sciences 7: 1159-1167. doi:10.1039/B802660M.
- ^
光合成 事典 .日本 光合成 学会 編 . - ^ Takaichi, S. & Mochimaru, M. (2007). “Carotenoids and carotenogenesis in cyanobacteria: Unique ketocarotenoids and carotenoid glycosides”. Cell Mol. Life Sci. 64: 2607-2619. doi:10.1007/s00018-007-7190-z.
- ^ Scherer, S., Almon, H. & Böger, P. (1988). “Interaction of photosynthesis, respiration and nitrogen fixation in cyanobacteria”. Photosynthesis Research 15: 95-114. doi:10.1007/BF00035255.
- ^ Zhang, S. & Bryant, D. A. (2011). “The tricarboxylic acid cycle in cyanobacteria”. Science 334: 1551-1553. doi:10.1126/science.1210858.
- ^ Stewart, W.D.P. (1980). “Some aspects of structure and function in N fixing cyanobacteria”. Annual Reviews in Microbiology 34: 497-536. doi:10.1146/annurev.mi.34.100180.002433.
- ^ Berman-Frank, I., Lundgren, P. & Falkowski, P. (2003). “Nitrogen fixation and photosynthetic oxygen evolution in cyanobacteria”. Res. Microbiol. 154: 157-164. doi:10.1016/S0923-2508(03)00029-9.
- ^ Díez, B., Bergman, B. & El-Shehawy, R. (2008). “Marine diazotrophic cyanobacteria: out of the blue”. Plant Biotechnol. 25: 221-225. doi:10.5511/plantbiotechnology.25.221.
- ^ Rippka, R., Deruelles, J., Waterbury, J. B., Herdman, M. & Stanier, R. Y. (1979). “Generic assignments, strain histories and properties of pure cultures of cyanobacteria”. Microbiology 111: 1-61. doi:10.1099/00221287-111-1-1.
- ^ León, C., Kumazawa, S. & Mitsui, A. (1986). “Cyclic appearance of aerobic nitrogenase activity during synchronous growth of unicellular cyanobacteria”. Current Microbiology 13: 149-153. doi:10.1007/BF01568510.
- ^ El-Shehawy, R., Lugomela, C., Ernst, A. & Bergman, B. (2003). “Diurnal expression of hetR and diazocyte development in the filamentous non-heterocystous cyanobacterium Trichodesmium erythraeum”. Microbiology 149: 1139-1146. doi:10.1099/mic.0.26170-0.
- ^ a b Bergman, B., Sandh, G., Lin, S., Larsson, J. & Carpenter, E. J. (2013). “Trichodesmium - a widespread marine cyanobacterium with unusual nitrogen fixation properties”. FEMS Microbiology Reviews 37: 286-302. doi:10.1111/j.1574-6976.2012.00352.x.
- ^ “
藍 藻 の分類 ”.浮遊 性 藍 藻 データベース.国立 科学 博物館 . 2021年 9月 25日 閲覧 。 - ^ Wolk, C.P., Ernst, A., Elhai, J. (1994). “Heterocyst metabolism and development”. In Bryant, D.A.. The Molecular Biology of Cyanobacteria. Kluwer Academic Publishers. pp. 769-823. ISBN 0792332229
- ^ Kumar, K., Mella-Herrera, R. A. & Golden, J. W. (2010). “Cyanobacterial heterocysts”. Cold Spring Harbor Perspectives in Biology 2: a000315. doi:10.1101/cshperspect.a000315.
- ^ Marco, G., Lange, C. & Soppa, J. (2011). “Ploidy in cyanobacteria”. FEMS Microbiology Letters 323: 124-131. doi:10.1111/j.1574-6968.2011.02368.x.
- ^ Kaneko, T., Sato, S., Kotani, H., Tanaka, A., Asamizu, E., Nakamura, Y., ... & Kimura, T. (1996). “Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions”. DNA Research 3: 109-136. doi:10.1093/dnares/3.3.109.
- ^ Herdman, M., Janvier, M., Rippka, R. & Stanier, R. Y. (1979). “Genome size of Cyanobacteria”. Journal of General Microbiology 111: 73-85. doi:10.1099/00221287-111-1-73.
- ^
広瀬 侑、佐藤 桃子 、池内 昌彦 「シアノバクテリア (光合成 研究 法 ) -- (植物 ・藻類 ・細菌 の材料 の入手 と栽培 ・培養 )」『低温 科学 』第 67巻 、北海道大学 低温 科学 研究所 、2008年 、9-15頁 、ISSN 18807593、NAID 120001492974。 - ^ a b Duggan, P. S., Gottardello, P. & Adams, D. G. (2007). “Molecular analysis of genes involved in pilus biogenesis and plant infection in Nostoc punctiforme”. J. Bacteriol. 189: 4547-4551. doi:10.1128/JB.01927-06.
- ^ Jarrell, K.F. & McBride, M.J. (2008). “The surprisingly diverse ways that prokaryotes move”. Nature Reviews Microbiology 6: 466-476. doi:10.1038/nrmicro1900.
- ^ Montgomery, B. L. (2007). “Sensing the light: photoreceptive systems and signal transduction in cyanobacteria”. Molecular Microbiology 64: 16-27. doi:10.1111/j.1365-2958.2007.05622.x.
- ^
広瀬 侑、池内 昌彦 「シアノバクテリアの補色 順化 における光 色 感知 機構 」『化学 と生物 』第 54巻 第 6号 、日本 農芸 化 学会 、2016年 、403-407頁 、doi:10.1271/kagakutoseibutsu.54.403、ISSN 0453-073X、NAID 130006772575。 - ^ Anagnostidis, K. & Komárek, J. (1988). “Modern approach to the classification system of cyanophytes. 3. Oscillatoriales”. Archiv für Hydrobiologie/Algological Studies 50/53: 327-472.
- ^ Meeks, J. C. & Elhai, J. (2002). “Regulation of cellular differentiation in filamentous cyanobacteria in free-living and plant-associated symbiotic growth states”. Microbiology and Molecular Biology Reviews 66: 94-121. doi:10.1128/MMBR.66.1.94-121.2002.
- ^ Kaplan-Levy, R. N., Hadas, O., Summers, M. L., Rücker, J., & Sukenik, A. (2010). “Akinetes: dormant cells of cyanobacteria”. Dormancy and Resistance in Harsh Environments. Springer Berlin Heidelberg. pp. 5-27. ISBN 978-3-642-12421-1.
- ^ Zhang, C.-C., Laurent, S., Sakr, S., Peng, L. & Bédu, S. (2006). “Heterocyst differentiation and pattern formation in cyanobacteria: a chorus of signals.”. Mol. Microbiol. 59: 367-375. doi:10.1111/j.1365-2958.2005.04979.x.
- ^ a b Coleman, M. L., Sullivan, M. B., Martiny, A. C., Steglich, C., Barry, K., DeLong, E. F. & Chisholm, S. W. (2006). “Genomic islands and the ecology and evolution of Prochlorococcus”. Science 311: 1768-1770. doi:10.1126/science.1122050.
- ^ a b c Whitton, B.A. & Potts, M. (2000). The Ecology of Cyanobacteria: Their Diversity in Time and Space. Kluwer Academic Pub.. pp. 669. ISBN 0-09-941464-3
- ^ a b c Whitton, B.A., ed (2012). Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer Science & Business Media. ISBN 978-94-007-3854-6
- ^ Garcia-Pichel, F., Belnap, J., Neuer, S. & Schanz, F. (2003). “Estimates of global cyanobacterial biomass and its distribution”. Algological Studies 109: 213-227. doi:10.1127/1864-1318/2003/0109-0213.
- ^ a b c Castenholz, R.W. & Waterbury, J.B. (1989). “Oxygenic photosynthetic bacteria. Group I. Cyanobacteria”. Bergey’s Manual of Systematic Bacteriology 3: 1710-1789.
- ^ a b Quesada, A. & Vincent, W. F. (2012). “Cyanobacteria in the cryosphere: snow, ice and extreme cold”. Ecology of Cyanobacteria II. Springer Net.. pp. 387-399. ISBN 978-94-007-3854-6.
- ^ Steinberg, C.E.W., Schäfer, H., Beisker, W., Brüggemann, R. (1998). “Deriving restoration goals for acidified lakes from taxonomic studies”. Restor, Ecol. 6: 327-335. doi:10.1046/j.1526-100X.1998.06403.x.
- ^ van Liere, L. & Walsby, A.E. (1982). “Interactions of cyanobacteria with light”. In Carr, N.G. and Whitton, B.A.. The Biology of the Cyanobacteria. Blackwell Science Publications. pp. 9-45. ISBN 0-520-04717-6.
- ^ a b c Walter, J. M., Coutinho, F. H., Dutilh, B. E., Swings, J., Thompson, F. L. & Thompson, C. C. (2017). “Ecogenomics and taxonomy of Cyanobacteria phylum”. Frontiers in Microbiology 8: 2132. doi:10.3389/fmicb.2017.02132.
- ^ Weisse, T. (1993). “Dynamics of autotrophic picoplankton in marine and freshwater ecosystems”. In Jones, J.G.. Advances in Microbial Ecology, Vol. 13. Plenum Press. pp. 327-370. doi:10.1007/978-1-4615-2858-6_8.
- ^ Veldhuis, M.J.W., Kraay, G.W., van Bleijswijk, J.D.L. & Baars, M.A. (1997). “Seasonal and spatial variability in phytoplankton biomass, productivity and growth in the northwestern Indian ocean: the southwest and northeast monsoon, 1992-1993”. Deep Sea Research Part I: Oceanographic Research Papers 44: 425-449. doi:10.1016/S0967-0637(96)00116-1.
- ^ Zwirglmaier, K., Jardillier, L., Ostrowski, M., Mazard, S., Garczarek, L., Vaulot, D., Not, F., Massana, R., Utioa, O. & Scanlan, D. J. (2008). “Global phylogeography of marine Synechococcus and Prochlorococcus reveals a distinct partitioning of lineages among oceanic blooms”. Environ. Microbiol. 10: 147-161. doi:10.3389/fmicb.2018.01393.
- ^ Flombaum, P., Gallegos, J. L., Gordillo, R. A., Rincón, J., Zabala, L. L., Jiao, N., ... & Vera, C. S. (2013). “Present and future global distributions of the marine Cyanobacteria Prochlorococcus and Synechococcus”. Proc. Natl. Acad. Sci. U.S.A. 110: 9824-9829. doi:10.1073/pnas.1307701110.
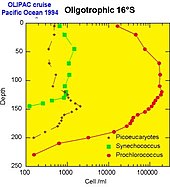
- ^ Callieri, C. (2007). “Picophytoplankton in freshwater ecosystems: the importance of small-sized phototrophs”. Freshwater Reviews 1: 1-28. doi:10.1608/FRJ-1.1.1.
- ^ “ネンジュモ
目 ”.浮遊 性 藍 藻 データベース.国立 科学 博物館 . 2021年 9月 25日 閲覧 。 - ^ a b
渡辺 真利 代 ;原田 健一 ;藤木 博 太 (編 ) (1994). アオコ : その出現 と毒素 .東京 大学 出版 会 . pp. 257. ISBN 4-13-066152-3. NCID BN11097702 - ^ Manage, P.M., Kawabata, Z. & Nakano, S. (2001). “Dynamics of cyanophage-like particles and algicidal bacteria causing Microcystis aeruginosa mortality”. Limnology 2: 73-78. doi:10.1007/s102010170002.
- ^ Sukenik, A., Eshkol, R., Livne, A., Hadas, O., Rom, M., Tchernov, D., Vardi, A. & Kaplan, A. (2002). “Inhibition of growth and photosynthesis of the dinoflagellate Peridinium gatunense by Microcystis sp. (cyanobacteria): a novel allelopathic mechanism”. Limnol. Oceanogr. 47: 1656-1663. doi:10.4319/lo.2002.47.6.1656.
- ^ Mizuta, S., Imai, H., Chang, K.-H., Doi, H., Nishibe, Y. & Nakano, S. (2010). “Grazing on Microcystis (Cyanophyceae) by testate amoebae with special reference to cyanobacterial abundance and physiological state”. Limnplogy 12: 205-211. doi:10.1007/s10201-010-0341-1.
- ^ Zotina, T., Köster, O. & Jüttner, F. (2003). “Photoheterotrophy and light‐dependent uptake of organic and organic nitrogenous compounds by Planktothrix rubescens under low irradiance”. Freshwater Biology 48: 1859-1872. doi:10.1046/j.1365-2427.2003.01134.x.
- ^ a b Tang, E. P. Y., Tremblay, R. & Vincent, W. F. (1997). “Cyanobacterial dominance of polar freshwater ecosystems: are high-latitude mat-formers adapted to low temperature?”. J. Phycol. 33: 171-181. doi:10.1111/j.0022-3646.1997.00171.x.
- ^ Shapiro, R. S. (2000). “A comment on the systematic confusion of thrombolites”. Palaios 15 (2): 166-169. doi:10.2307/3515503.
- ^ Corsetti, F. A., Awramik, S. M. & Pierce, D. (2003). “A complex microbiota from snowball Earth times: microfossils from the Neoproterozoic Kingston Peak Formation, Death Valley, USA”. Proc. Natl. Acad. Sci. U.S.A. 100: 4399-4404. doi:10.1073/pnas.0730560100.
- ^ Ward, D. M. & Castenholz, R. W. (2000). “Cyanobacteria in geothermal habitats”. The Ecology of Cyanobacteria. Springer Netherlands. pp. 37-59. ISBN 0-09-941464-3
- ^ Wierzchos, J., Ascaso, C. & McKay, C. P. (2006). “Endolithic cyanobacteria in halite rocks from the hyperarid core of the Atacama Desert”. Astrobiology 6: 415-422. doi:10.1089/ast.2006.6.415.
- ^
竹内 望 「クリオコナイトと氷河 の暗色 化 」『低温 科学 』第 70巻 、北海道大学 低温 科学 研究所 、2012年 、165-172頁 、ISSN 1880-7593、NAID 40019324597。 - ^ Fulda, S., Mikkat, S., Schroder, W., Hagemann, M. (1999). “Isolation of salt-induced periplasmic proteins from Synechocystis sp. strain PCC 6803”. Arch. Microbiol. 171: 214-217. doi:10.1007/s002030050702.
- ^ a b c Adams, D. G. (2000). “Symbiotic interactions”. In Whitton, B.A. & Potts, M.. Ecology of Cyanobacteria: Their Diversity in Time and Space. Kluwer Academic Publishers. pp. 523-561. ISBN 0-09-941464-3
- ^ a b c d Adams, D. G., Duggan, P. S. & Jackson, O. (2012). “Cyanobacterial symbioses”. In Whitton, B.A.. Ecology of Cyanobacteria II: Their Diversity in Space and Time. Springer Science+Business Media B.V.. pp. 593-675. ISBN 978-94-007-3854-6
- ^ a b c Adams, D. G., Bergman, B., Nierzwicki-Bauer, S. A., Rai, A. N. & Schüßler, A. (2006). “Cyanobacterial-plant symbioses”. In Dworkin M, Falkow S, Rosenberg E, Schleifer K-H, Stackebrandt E. The Prokaryotes. A Handbook on the Biology of Bacteria, vol 1, 3rd ed. Symbiotic Associations, Biotechnology, Applied Microbiology. Springer. pp. 331-363. ISBN 978-1-4757-2193-5
- ^ a b Carpenter, E.J. (2002). “Marine cyanobacterial symbioses”. Biol. Environ. Proc. R Ir Acad. 102B: 15-18. doi:10.1007/0-306-48005-0_2.
- ^ Paerl, H. (1992). “Epi- and endobiotic interactions of cyanobacteria”. In Reisser, W.. Algae and Symbioses: Plants, Animals, Fungi, Viruses, Interactions Explored. Biopress Limited. pp. 537-565
- ^ Decelle, J., Colin, S. & Foster, R. A. (2015). “Photosymbiosis in marine planktonic protists”. Marine Protists. Springer Japan. pp. 465-500. doi:10.1007/978-4-431-55130-0_19
- ^ a b Rikkinen, J. (2002). “Cyanolichens: an evolutionary overview”. In Rai, A.N., Bergman, B. & Rasmussen, U.. Cyanobacteria in Symbiosis. Kluwer Academic Publishers, Dordrecht. pp. 31-72. ISBN 1-4020-0777-9
- ^ Gehrig, H., Schüßler, A. & Kluge, M. (1996). “Geosiphon pyriforme, a fungus forming endocytobiosis withNostoc (Cyanobacteria), is an ancestral member of the glomales: evidence by SSU rRNA analysis”. Journal of Molecular Evolution 43: 71-81. doi:10.1007/BF02352301.
- ^ Mollenhauer, D., Mollenhauer, R. & Kluge, M. (1996). “Studies on initiation and development of the partner association in Geosiphon pyriforme (Kütz.) v. Wettstein, a unique endocytobiotic system of a fungus (Glomales) and the cyanobacterium Nostoc punctiforme (Kütz.) Hariot”. Protoplasma 193: 3-9. doi:10.1007/BF01276630.
- ^ Schüßler, A. & Wolf, E. (2005). “Geosiphon pyriformis - a Glomeromycotan soil fungus forming endosymbiosis with Cyanobacteria”. In Vitro Culture of Mycorrhizas. Soil Biology, Volume 4, Part V. pp. 271-289. ISBN 3-540-24027-6
- ^ Usher, K.M. (2008). “The ecology and phylogeny of cyanobacterial symbionts in sponges”. Marine Ecology 29: 178-192. doi:10.1111/j.1439-0485.2008.00245.x.
- ^ Lindquist, N., Barber, P.H. & Weisz, J.B. (2005). “Episymbiotic microbes as food and defence for marine isopods: unique symbioses in a hostile environment”. Proc. R Soc. Lond. B 272: 1209-1216. doi:10.1098/rspb.2005.3082.
- ^ Münchhoff, J., Hirose, E., Maruyama, T., Sunairi, M., Burns, B.P., & Neilan, B.A. (2007). “Host specificity and phylogeography of the prochlorophyte Prochloron sp., an obligate symbiont in didemnid ascidians”. Environ. Microbiol. 9: 890-899. doi:10.1111/j.1462-2920.2006.01209.x.
- ^ a b c Foster, R. A. Carpenter, E. J. & Bergman, B. (2006). “Unicellular cyanobionts in open ocean dinoflagellates, radiolarians, and tintinnids: ultrastructural characterization and immuno-localization of phycoerythrin and nitrogenase”. Journal of Phycology 42: 453-463. doi:10.1111/j.1529-8817.2006.00206.x.
- ^ a b c Foster, R. A., Collier, J. L. & Carpenter , E. J. (2006). “Reverse transcription PCR amplification of cyanobacterial symbiont 16S rRNA sequences from single non-photosynthetic eukaryotic marine planktonic host cells”. Journal of Phycology 42: 243-250. doi:10.1111/j.1529-8817.2006.00185.x.
- ^ Lee, J.J. (2006). “Algal symbiosis in larger foraminifera”. Symbiosis 42: 63-75.
- ^ Escalera, L., Reguera, B., Takishita, K., Yoshimatsu, S., Koike, K. & Koike, K. (2011). “Cyanobacterial endosymbionts in the benthic dinoflagellate Sinophysis canaliculata (Dinophysiales, Dinophyceae)”. Protist 162: 304-314. doi:10.1016/j.protis.2010.07.003.
- ^ Jyothibabu, R., Madhu, N.V., Maheswaran, P.A., Devi, C.R.A., Balasubramanian, T., Nair, K.K.C. & Achuthankutty, C.T. (2006). “Environmentally-related seasonal variation in symbiotic associations of heterotrophic dinoflagellates with cyanobacteria in the western Bay of Bengal”. Symbiosis 42: 51-58.
- ^ a b Archibald, J.M. (2009). “The puzzle of plastid evolution”. Curr. Biol. 19: R81-88. doi:10.1016/j.cub.2008.11.067.
- ^
中山 卓郎 、石田 健一郎 「もう一 つの一 次 共生 ?-Paulinella chromatophora とそのシアネレ―」『原生動物 学 雑誌 』第 41巻 第 1号 、日本 原生 生物 学会 、2008年 、27-31頁 、doi:10.18980/jjprotozool.41.1_27、ISSN 0388-3752、NAID 130006070219。 - ^ Rai, A. N., Söderbäck, E. & Bergman, B. (2000). “Cyanobacterium-plant symbioses”. New Phytologist 147: 449-481. doi:10.1046/j.1469-8137.2000.00720.x.
- ^ a b Adams, D. G. & Duggan, P. S. (2008). “Cyanobacteria-bryophyte symbioses”. J. Exp. Bot. 59: 1047-1058. doi:10.1093/jxb/ern005.
- ^ Peters, G.A. (1991). “Azolla and other plant-cyanobacteria symbioses - aspects of form and function”. Plant Soil 137: 25-36. doi:10.1007/BF02187428.
- ^ a b Papaefthimiou, D., Van Hove, C., Lejeune, A., Rasmussen, U. & Wilmotte, A. (2008). “Diversity and host specificity of genus Azolla cyanobionts”. J. Phycol. 44: 60-70. doi:10.1111/j.1529-8817.2007.00448.x.
- ^ Costa, J.-L. & Lindblad, P. (2003). “Cyanobacteria in symbiosis with cycads”. In Rai, A.N., Bergman, B. & Rasmussen, U.. Cyanobacteria in Symbiosis. Kluwer Academic Publishers, Dordrecht. pp. 195-205. ISBN 1-4020-0777-9
- ^ Bergman, B. (2002). “The Nostoc-Gunnera symbiosis”. In Rai, A.N., Bergman, B. & Rasmussen, U.. Cyanobacteria in Symbiosis. Kluwer Academic Publishers. pp. 207-232. ISBN 1-4020-0777-9
- ^ Bergman, B. & Osborne, B. (2002). “The Gunnera-Nostoc symbiosis”. Biol. Environ. Proc. R Ir Acad. 102B: 35-39.
- ^ Cox, P.A., Banack, S.A. & Murch, S.J. (2003). “Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam”. Proc. Natl. Acad. Sci. U.S.A. 100: 13380-13383. doi:10.1073/pnas.2235808100.
- ^ Jahson, S., Rai, A. N. & Bergman, B. (1995). “Intracellular cyanobiont Richelia intracellularis: ultrastructure and immuno-localisation of phycoerythrin, nitrogenase, Rubisco and glutamine synthetase”. Marine Biology 124: 1-8. doi:10.1007/BF00349140.
- ^ Foster, R. A. & Zehr, J. P. (2006). “Characterization of diatom-cyanobacteria symbioses on the basis of nifH, hetR and 16S rRNA sequences”. Environ. Microbiol. 8: 1913-1925. doi:10.1111/j.1462-2920.2006.01068.x.
- ^ Foster, R.A., Kuypers, M.M.M., Vagner, T., Paerl, R.W., Muzat, N. & Zehr, J.P. (2011). “Nitrogen fixation and transfer in open ocean diatom-cyanobacterial symbioses”. ISME J. 5: 1484-1493. doi:10.1038/ismej.2011.26.
- ^ Foster, R.A., Subramaniam, A. & Zehr, J.P. (2009). “Distribution and activity of diazotrophs in the Eastern Equatorial Atlantic”. Environ. Microbiol. 11: 741-750. doi:10.1111/j.1462-2920.2008.01796.x.
- ^ White, A.E., Prahl, F.G., Letelier, R.M. & Popp, B.N. (2007). “Summer surface waters in the Gulf of California: prime habitat for biological nitrogen fixation”. Glob. Biogeochem. Cycles 21: GB2017. doi:10.1029/2006GB002779.
- ^ Hagino, K., Onuma, R., Kawachi, M. & Horiguchi, T. (2013). “Discovery of an endosymbiotic nitrogen-fixing cyanobacterium UCYN-A in Braarudosphaera bigelowii (Prymnesiophyceae)”. PLoS One 8: e81749. doi:10.1371/journal.pone.0081749.
- ^ Thompson, A., Carter, B. J., Turk‐Kubo, K., Malfatti, F., Azam, F. & Zehr, J. P. (2014). “Genetic diversity of the unicellular nitrogen‐fixing cyanobacteria UCYN‐A and its prymnesiophyte host”. Environmental Microbiology 16: 3238-3249. doi:10.1111/1462-2920.12490.
- ^ Kneip, C., Voß, C., Lockhart, P. J. & Maier, U. G. (2008). “The cyanobacterial endosymbiont of the unicellular algae Rhopalodia gibba shows reductive genome evolution”. BMC Evol. Biol. 8: 30. doi:10.1111/1462-2920.12490.
- ^ Lesser, M. P., Mazel, C. H., Gorbunov, M. Y. & Falkowski, P. G. (2004). “Discovery of symbiotic nitrogen-fixing cyanobacteria in corals”. Science 305: 997-1000. doi:10.1126/science.1099128.
- ^ Lesser, M.P., Falcón, L.I., Rodriguez-Roman, A., Enriquez, S., Hoegh-Guldberg, O. & Iglesias-Prieto, R. (2007). “Nitrogen fixation by symbiotic cyanobacteria provides a source of nitrogen for the scleractinian coral Montastraea cavernosa”. Mar. Ecol. Prog. Ser. 346: 143-152. doi:10.3354/meps07008.
- ^ Snoeijs, P. & Murasi, L.W. (2004). “Symbiosis between diatoms and cyanobacterial colonies”. Vie Et Milieu Life Environ 54: 163-169.
- ^ Fong, P., Smith, T.B. & Wartian, M.J. (2006). “Epiphytic cyanobacteria maintain shifts to macroalgal dominance on coral reefs following ENSO disturbance”. Ecology 87: 1162-1168. doi:10.1890/0012-9658(2006)87[1162:ECMSTM]2.0.CO;2.
- ^ Ohkubo, S., Miyashita, H., Murakami, A., Takeyama, H., Tsuchiya, T. & Mimuro, M. (2006). “Molecular detection of epiphytic Acaryochloris spp. on marine macroalgae”. Appl. Environ. Microbiol. 72: 7912-7915. doi:10.1128/AEM.01148-06.
- ^ Ariosa, Y., Quesada, A., Aburto, J., Carrasco, D., Carreres, R., Leganes, F. & Valiente, E.F. (2004). “Epiphytic cyanobacteria on Chara vulgaris are the main contributors to N2 fixation in rice fields”. Appl. Environ. Microbiol. 70: 5391-5397. doi:10.1128/AEM.70.9.5391-5397.2004.
- ^ Berg, A., Danielsson, Å. & Svensson, B. H. (2013). “Transfer of fixed-N from N2-fixing cyanobacteria associated with the moss Sphagnum riparium results in enhanced growth of the moss”. Plant and Soil 362: 271-278. doi:10.1007/s11104-012-1278-4.
- ^ Solheim, B. & Zielke, M. (2002). “Associations between cyanobacteria and mosses”. In Rai, A.N., Bergman, B. & Rasmussen, U.. Cyanobacteria in Symbiosis. Kluwer Academic Publishers, Dordrecht. pp. 137-152. ISBN 1-4020-0777-9.
- ^ Steinke, T.D., Lubke, R.A. & Ward, C.J. (2003). “The distribution of algae epiphytic on pneumatophores of the mangrove, Avicennia marina, at different salinities in the Kosi System”. S. Afr. J. Bot. 69: 546-554. doi:10.1016/S0254-6299(15)30293-3.
- ^ Hamisi, M.I., Lyimo, T.J., Muruke, M.H.S. & Bergman, B. (2009). “Nitrogen fixation by epiphytic and epibenthic diazotrophs associated with seagrass meadows along the Tanzanian coast, Western Indian Ocean”. Aquat. Microb. Ecol. 57: 33-42. doi:10.3354/ame01323.
- ^ Uku, J., Bjork, M., Bergman, B. & Diez, B. (2007). “Characterization and com- parison of prokaryotic epiphytes associated with three East African seagrasses”. J. Phycol. 43: 768-779. doi:10.1111/j.1529-8817.2007.00371.x.
- ^ Tsavkelova, E.A., Lobakova, E.S., Kolomeitseva, G.L., Cherdyntseva, T.A. & Netrusov, A.I. (2003). “Associative cyanobacteria isolated from the roots of epiphytic orchids”. Microbiology 72: 92-97. doi:10.1023/A:1022238309083.
- ^ Watson, S.B. (2003). “Cyanobacterial and eukaryotic algal odour compounds: signals or by-products? A review of their biological activity”. Phycologia 42: 332-350. doi:10.2216/i0031-8884-42-4-332.1.
- ^
佐野 友 春 (2012). “ラン藻 の毒素 (ミクロシスチン、ノジュラリン)”. In渡邉 信 (監 ).藻類 ハンドブック. エヌ・ティー・エス. pp. 243–249. ISBN 978-4864690027 - ^
彼 谷 邦光 (2012). “ラン藻 の毒素 (その他 の毒素 )”. In渡邉 信 (監 ).藻類 ハンドブック. エヌ・ティー・エス. pp. 251–255. ISBN 978-4864690027 - ^ Codd, G. A., Morrison, L. F. & Metcalf, J. S. (2005). “Cyanobacterial toxins: risk management for health protection”. Toxicology and Applied Pharmacology 203: 264-272. doi:10.1016/j.taap.2004.02.016.
- ^ Jang, M.H., Ha, K., Joo, G.J. & Takamura, N. (2003). “Toxin production of cyanobacteria is increased by exposure to zooplankton”. Freshwater Biol. 48: 1540-1550.
- ^ Wiegand, C. & Pflugmacher, S. (2005). “Ecotoxicological effects of selected cyanobacterial secondary metabolites a short review”. Toxicology and Applied Pharmacology 203: 201-218. doi:10.1016/j.taap.2004.11.002.
- ^
渡辺 文雄 ,桂 博美 ,阿部 捷 男 ,竹中 重雄 ,田村 良行 ,中野 長久 「2-II-17機能 性 食品 スピルリナ錠剤 に含 まれるビタミンB_<12>同族 体 の単 離 と同定 」『ビタミン』第 73巻 第 4号 、日本 ビタミン学会 、1999年 、282頁 、doi:10.20632/vso.73.4_282_2。 - ^
食品 安全 関係 情報 詳細 資料 管理 ID:syu04830460475食品 安全 委員 会 - ^ “【
初心者 向 き】水槽 のコケ対策 と種類 をプロがアドバイス!”. トロピカ.株式会社 東京 アクアガーデン. 2021年 9月 23日 閲覧 。 - ^ “【コケ
種類 別 】熱帯魚 飼育 におすすめのコケ取 り名人 ”. GEX. 2021年 9月 23日 閲覧 。 - ^ a b c d
太郎 田 博之 (2012). “スピルリナ”. In渡邉 信 (監 ).藻類 ハンドブック. エヌ・ティー・エス. pp. 657–659. ISBN 978-4864690027 - ^ Sili, C., Torzillo, G. & Vonshak, A. (2012). “Arthrospira (Spirulina)”. Ecology of Cyanobacteria II. Springer Netherlands. pp. 677-705. ISBN 978-94-007-3854-6
- ^ “フィコシアニン(
天然 系 青色 素 リナブルー®)”. DIC. 2022年 11月5日 閲覧 。 - ^
有賀 祐 勝 (2012). “髪 菜 ”. In渡邉 信 (監 ).藻類 ハンドブック. エヌ・ティー・エス. pp. 655–656. ISBN 978-4864690027 - ^
竹中 裕行 &山口 裕司 (2012). “ノストック (イシクラゲ)”. In渡邉 信 (監 ).藻類 ハンドブック. エヌ・ティー・エス. pp. 651–654. ISBN 978-4864690027 - ^
吉田 忠生 (2012). “スイゼンジノリ”. In渡邉 信 (監 ).藻類 ハンドブック. エヌ・ティー・エス. pp. 648–650. ISBN 978-4864690027 - ^
渡辺 巌 「アカウキクサ-ラン藻 の共生 による生物 的 窒素 固定 とその利用 」『日本 土壌 肥料 学 雑誌 』第 52巻 第 5号 、日本 土壌 肥料 學會 、1981年 、455-464頁 、doi:10.20710/dojo.52.5_455、ISSN 0029-0610、NAID 110001750611。 - ^ Hemscheidt, T., Puglisi, M.P., Larsen, L.K., Patterson, G.M.L., Moore, R.E., Rios, J.L. & Clardy, J. (1994). “Structure and biosynthesis of borophycin, a new boeseken complex of boric acid from a marine strain of the blue-green alga Nostoc linckia”. J. Org. Chem. 59: 3467-3471. doi:10.1021/jo00091a042.
- ^ Jensen, G. S. (2001). “Blue-green algae as an immuno-enhancer and biomodulator” (PDF). J. Am. Nutraceutical Assoc. 3: 24-30. NAID 10020842775.
- ^ Choi, H., Mascuch, S. J., Villa, F. A., Byrum, T., Teasdale, M. E., Smith, J. E., ... & Gerwick, W. H. (2012). “Honaucins A−C, potent inhibitors of inflammation and bacterial quorum sensing: synthetic derivatives and structure-activity relationships”. Chemistry & Biology 19: 589-598. doi:10.1016/j.chembiol.2012.03.014.
- ^ Grewe, C. B. & Pulz, O. (2012). “The biotechnology of cyanobacteria”. Ecology of Cyanobacteria II. Springer Netherlands. pp. 707-739. ISBN 978-94-007-3854-6
- ^ a b
日原 由香子 ,成川 礼 ,蓮沼 誠 久 ,増川 一 ,朝山 宗彦 ,蘆 田 弘樹 ,天尾 豊 ,新井 宗 仁 ,粟井 光一郎 ,得平 茂樹 ,小山内 崇 , 鞆達也 「多彩 な戦略 で挑 むシアノバクテリア由来 の燃料 生産 :持続 可能 な第 三 世代 バイオ燃料 生産 の最前線 」『化学 と生物 』第 55巻 第 2号 、日本 農芸 化 学会 、2017年 、88-97頁 、doi:10.1271/kagakutoseibutsu.55.88、ISSN 0453-073X、NAID 130006316058。 - ^
蘆 田 弘樹 「シアノバクテリアの光合成 能力 を利用 したバイオ燃料 生産 」『生物 工 学会 誌 』第 91巻 第 6号 、日本 生物 工 学会 、2013年 6月 、352頁 、ISSN 09193758、NAID 110009616015、NDLJP:10518477。 - ^ Lane, J. (2013). “Algenol hits 9K gallons/acre mark for algae-to-ethanol process”]. Biofuels Digest.
- ^ Pisciotta, J. M., Zou, Y. & Baskakov, I. V. (2010). “Light-dependent electrogenic activity of cyanobacteria”. PloS One 5: e10821. doi:10.1371/journal.pone.0010821.
- ^ Quintana, N., Van der Kooy, F., Van de Rhee, M. D., Voshol, G. P. & Verpoorte, R. (2011). “Renewable energy from Cyanobacteria: energy production optimization by metabolic pathway engineering”. Applied Microbiology and Biotechnology 91: 471-490. doi:10.1007/s00253-011-3394-0.
- ^ Verseux, C., Baque, M., Lehto, K., de Vera, J. P. P., Rothschild, L. J. & Billi, D. (2016). “Sustainable life support on Mars–the potential roles of cyanobacteria”. International Journal of Astrobiology 15: 65-92. doi:10.1017/S147355041500021X.
- ^ Battistuzzi, F. U. & Hedges, S. B. (2008). “A major clade of prokaryotes with ancient adaptations to life on land”. Molecular Biology and Evolution 26: 335-343. doi:10.1093/molbev/msn247.
- ^ Rinke, C., Schwientek, P., Sczyrba, A., Ivanova, N. N., Anderson, I. J., Cheng, J. F., ... & Dodsworth, J. A. (2013). “Insights into the phylogeny and coding potential of microbial dark matter”. Nature 499: 431-437. doi:10.1038/nature12352.
- ^ a b Soo, R. M., Skennerton, C. T., Sekiguchi, Y., Imelfort, M., Paech, S. J., Dennis, P. G., ... & Hugenholtz, P. (2014). “An expanded genomic representation of the phylum Cyanobacteria”. Genome Biology and Evolution 6: 1031-1045. doi:10.1093/gbe/evu073.
- ^ a b c d Soo, R. M., Hemp, J., Parks, D. H., Fischer, W. W. & Hugenholtz, P. (2017). “On the origins of oxygenic photosynthesis and aerobic respiration in Cyanobacteria”. Science 355: 1436-1440. doi:10.1126/science.aal3794.
- ^ Carnevali, P. B. M., Schulz, F., Castelle, C. J., Kantor, R. S., Shih, P. M., Sharon, I., ... & Anantharaman, K. (2019). “Hydrogen-based metabolism as an ancestral trait in lineages sibling to the Cyanobacteria”. Nature Communications 10: 463. doi:10.1038/s41467-018-08246-y.
- ^ a b Shih, P. M., Hemp, J., Ward, L. M., Matzke, N. J. & Fischer, W. W. (2017). “Crown group Oxyphotobacteria postdate the rise of oxygen”. Geobiology 15: 19-29. doi:10.1111/gbi.12200.
- ^ Overmann, Jörg; Garcia-Pichel, Ferran (2013), Rosenberg, Eugene; DeLong, Edward F., eds. (
英語 ), The Phototrophic Way of Life, Springer, pp. 203–257, doi:10.1007/978-3-642-30123-0_51, ISBN 978-3-642-30123-0 2021年 10月 4日 閲覧 。 - ^ Shih, Patrick M.; Ward, Lewis M.; Fischer, Woodward W. (2017-10-03). “Evolution of the 3-hydroxypropionate bicycle and recent transfer of anoxygenic photosynthesis into the Chloroflexi” (
英語 ). Proceedings of the National Academy of Sciences 114 (40): 10749–10754. doi:10.1073/pnas.1710798114. ISSN 0027-8424. PMC 5635909. PMID 28923961. - ^ Ward, L. M.; Shih, P. M. (2021-01-24) (
英語 ). Phototrophy and carbon fixation in Chlorobi postdate the rise of oxygen. pp. 2021.01.22.427768. doi:10.1101/2021.01.22.427768. - ^ Ward, Lewis M.; Cardona, Tanai; Holland-Moritz, Hannah (2019). “Evolutionary Implications of Anoxygenic Phototrophy in the Bacterial Phylum Candidatus Eremiobacterota (WPS-2)”. Frontiers in Microbiology 10: 1658. doi:10.3389/fmicb.2019.01658. ISSN 1664-302X. PMC 6664022. PMID 31396180.
- ^ a b Holland, H. D. (2006). “The oxygenation of the atmosphere and oceans”. Philosophical Transactions of the Royal Society: Biological Sciences 361: 903-915. doi:10.1098/rstb.2006.1838.
- ^ Anbar, Ariel D.; Duan, Yun; Lyons, Timothy W.; Arnold, Gail L.; Kendall, Brian; Creaser, Robert A.; Kaufman, Alan J.; Gordon, Gwyneth W. et al. (2007-09-28). “A Whiff of Oxygen Before the Great Oxidation Event?”. Science 317 (5846): 1903–1906. doi:10.1126/science.1140325.
- ^ Johnson, Aleisha C.; Ostrander, Chadlin M.; Romaniello, Stephen J.; Reinhard, Christopher T.; Greaney, Allison T.; Lyons, Timothy W.; Anbar, Ariel D.. “Reconciling evidence of oxidative weathering and atmospheric anoxia on Archean Earth”. Science Advances 7 (40): eabj0108. doi:10.1126/sciadv.abj0108.
- ^ French, Katherine L.; Hallmann, Christian; Hope, Janet M.; Schoon, Petra L.; Zumberge, J. Alex; Hoshino, Yosuke; Peters, Carl A.; George, Simon C. et al. (2015-05-12). “Reappraisal of hydrocarbon biomarkers in Archean rocks” (
英語 ). Proceedings of the National Academy of Sciences 112 (19): 5915–5920. doi:10.1073/pnas.1419563112. ISSN 0027-8424. PMC 4434754. PMID 25918387. - ^ Welander, Paula V.; Coleman, Maureen L.; Sessions, Alex L.; Summons, Roger E.; Newman, Dianne K. (2010-05-11). “Identification of a methylase required for 2-methylhopanoid production and implications for the interpretation of sedimentary hopanes” (
英語 ). Proceedings of the National Academy of Sciences 107 (19): 8537–8542. doi:10.1073/pnas.0912949107. ISSN 0027-8424. PMC 2889317. PMID 20421508. - ^ Lepot, K., Benzerara, K., Brown, G. E. & Philippot, P. (2008). “Microbially influenced formation of 2,724-million-year-old stromatolites”. Nature Geoscience 1: 118-121. doi:10.1038/ngeo107.
- ^ Schopf, J. W. (2006). “Fossil evidence of Archaean life”. Phil. Trans. R. Soc. B 361: 869-885. doi:10.1098/rstb.2006.1834.
- ^ Bosak, Tanja; Knoll, Andrew H.; Petroff, Alexander P. (2013-05-30). “The Meaning of Stromatolites”. Annual Review of Earth and Planetary Sciences 41 (1): 21–44. doi:10.1146/annurev-earth-042711-105327. ISSN 0084-6597.
- ^ Tomitani, A., Knoll, A. H., Cavanaugh, C. M. & Ohno, T. (2006). “The evolutionary diversification of cyanobacteria: molecular-phylogenetic and paleontological perspectives”. Proc. Natl. Acad. Sci. U.S.A. 103: 5442-5447. doi:10.1073/pnas.0600999103.
- ^ Farquhar, J. & Wing, B. A. (2003). “Multiple sulfur isotopes and the evolution of the atmosphere”. Earth and Planetary Science Letters 213: 1-13. doi:10.1016/S0012-821X(03)00296-6.
- ^ Yoon, H. S., Hackett, J. D., Ciniglia, C., Pinto, G. & Bhattacharya, D. (2004). “A molecular timeline for the origin of photosynthetic eukaryotes”. Molecular Biology and Evolution 21: 809-818. doi:10.1093/molbev/msh075.
- ^ Gould, S.B., Waller, R.F. & McFadden, G.I. (2008). “Plastid evolution”. Annu. Rev. Plant Biol. 59: 491-517. doi:10.1146/annurev.arplant.59.032607.092915.
- ^ a b c Ponce-Toledo, R. I., Deschamps, P., López-García, P., Zivanovic, Y., Benzerara, K. & Moreira, D. (2017). “An early-branching freshwater cyanobacterium at the origin of plastids”. Current Biology 27: 386-391. doi:10.1016/j.cub.2016.11.056.
- ^ Pascher, A. (1931). “Systematische Übersicht über die mit Flagellaten in Zusammenhang stehenden Algenreihen und Versuch einer Einreihung dieser Algenstämme in die Stämme des Pflanzenreiches”. Beihefte Bot Centralbl. 48: 317-332.
- ^ Round, F.E. (1973). The Biology of the Algae. 2nd Edition. 278
- ^ “
藻類 ”.光合成 事典 .日本 光合成 学会 . 2021年 9月 23日 閲覧 。 - ^
池内 昌彦 ,伊藤 元 己 ,箸 本 春樹 ,道上 達男 (監 訳 ) (2018). “藻類 ”. キャンベル生物 学 原書 11版 .丸善 出版 . p. 1584. ISBN 978-4621302767 - ^ Pringsheim, E.G. (1949). “The relationship between bacteria and Myxophyceae”. Bacteriological Reviews 13: 47-98.
- ^ Oren, A. (2004). “A proposal for further integration of the cyanobacteria under the Bacteriological Code”. International Journal of Systematic and Evolutionary Microbiology 54: 1895-1902. doi:10.1099/ijs.0.03008-0.
- ^ Lewin, R. A. (1976). “Prochlorophyta as a proposed new division of algae”. Nature 261: 697-698. doi:10.1038/261697b0.
- ^ Anagnostidis, K. & Komáreek, J. (1990). “Modern approach to the classification system of cyanophytes. 1. Introduction”. Archiv für Hydrobiologie/Algological Studies 38/39: 291-302.
- ^ a b c Hoffmann, L., Komárek, J. & Kastovský, J. (2005). “System of cyanoprokaryotes (cyanobacteria) - state in 2004”. Algological Studies 117: 95-115. doi:10.1127/1864-1318/2005/0117-0095.
- ^ Schirrmeister, B. E., Antonelli, A., Bagheri, H. C. (2011). “The origin of multicellularity in cyanobacteria”. BMC Evol. Biol. 11: 45. doi:10.1186/1471-2148-11-45.
- ^ Schirrmeister, B. E., Gugger, M. & Donoghue, P. C. (2015). “Cyanobacteria and the Great Oxidation Event: evidence from genes and fossils”. Palaeontology 58: 769-785. doi:10.1111/pala.12178.
- ^ Shih, P. M., Wu, D., Latifi, A., Axen, S. D., Fewer, D. P., Talla, E., ... & Herdman, M. (2013). “Improving the coverage of the cyanobacterial phylum using diversity-driven genome sequencing”. Proc. Natl. Acad. Sci. U.S.A. 110: 1053-1058. doi:10.1073/pnas.1217107110.
- ^ Uyeda, J. C., Harmon, L. J. & Blank, C. E. (2016). “A comprehensive study of cyanobacterial morphological and ecological evolutionary dynamics through deep geologic time”. PloS One 11: e0162539. doi:10.1371/journal.pone.0162539.
- ^ a b c Komárek, J., Kaštovský, J., Mareš, J. & Johansen, J.R. (2014). “Taxonomic classification of cyanoprokaryotes (cyanobacterial genera) 2014, using a polyphasic approach”. Preslia 86: 295-335.
- ^ Guiry, M.D. & Guiry, G.M. (2019) AlgaeBase. World-wide electronic publication, Nat. Univ. Ireland, Galway. http://www.algaebase.org; searched on 28 Septmber 2019.
- ^ a b Hauer, T. & Komárek, J. (2019) CyanoDB 2.0 - On-line database of cyanobacterial genera. - World-wide electronic publication, Univ. of South Bohemia & Inst. of Botany AS CR, http://www.cyanodb.cz
- ^ Komárek, J. (2018). “Several problems of the polyphasic approach in the modern cyanobacterial system”. Hydrobiologia 811: 7-17. doi:10.1007/s10750-017-3379-9.
- ^ Coutinho, F., Tschoeke, D. A., Thompson, F. & Thompson, C. (2016). “Comparative genomics of Synechococcus and proposal of the new genus Parasynechococcus”. PeerJ 4: e1522. doi:10.7717/peerj.1522.
- ^
廣瀬 弘幸 &山岸 高 旺 (編 )「藍 藻 綱 」『日本 淡水 藻 図鑑 』内田 老 鶴 圃、1977年 、1–151頁 。ISBN 978-4753640515。 - ^ a b
千原 光男 (編 ) (1999). “分類 表 ”. バイオディバーシティ・シリーズ (3)藻類 の多様 性 と系統 .裳 華 房 . pp. 297. ISBN 978-4785358266 - ^ Oren, A. (2011). “Cyanobacterial systematics and nomenclature as featured in the international bulletin of bacteriological nomenclature and taxonomy/international journal of systematic bacteriology/international journal of systematic and evolutionary microbiology”. International Journal of Systematic and Evolutionary Microbiology 61: 10-15. doi:10.1099/ijs.0.018838-0.
関連 項目 [編集 ]
- フィコビリン、フィコビリソーム、
窒素 固定 生態 :植物 プランクトン、ピコプランクトン、アオコ、ストロマトライト、温泉 藻 、クリオコナイト共生 :地衣 類 、ゲオシフォン、ウスバゼニゴケ科 、ツノゴケ類 、アカウキクサ属 、ソテツ類 、グンネラ- シアノトキシン (
藍 藻 毒 ): ミクロシスチン、ノジュラリン、ミクロビリジン、サキシトキシン、リングビアトキシンA、アプリシアトキシン、デブロモアプリシアトキシン、モオレア・プロドゥケンス 藍 藻 が生成 するカビ臭 物質 : 2-メチルイソボルネオール、ゲオスミン食用 藍 藻 : スピルリナ、アステカ料理 、スイゼンジノリ、アシツキ、髪 菜 、イシクラゲ原核 緑藻 、プロクロロン原生代 、細胞 内 共生 説
外部 リンク[編集 ]
- “
浮遊 性 藍 藻 データベース”.国立 科学 博物館 . 2021年 9月 26日 閲覧 。 - “アオコをつくる
藍 藻 ”.国立 科学 博物館 . 2021年 9月 26日 閲覧 。 - “シアノバクテリア
門 ”.写真 で見 る生物 の系統 と分類 生 きもの好 きの語 る自然 誌 . 2021年 9月 26日 閲覧 。 - “
藍 藻 ”. ねこのしっぽ -小 さな生物 の観察 記録 -. 2021年 9月 26日 閲覧 。 - “アオコ
現象 の原因 となるシアノバクテリア”.国立 環境 研究所 (2019年 6月 28日 ). 2021年 9月 26日 閲覧 。 - “CyanoDB”. 2021
年 9月 26日 閲覧 。 (英語 ) - “Phylum Cyanobacteria”. AlgaeBase. 2021
年 9月 26日 閲覧 。 (英語 )